
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
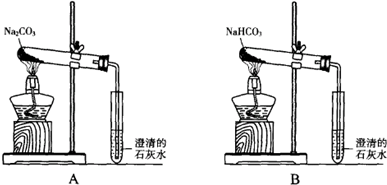
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
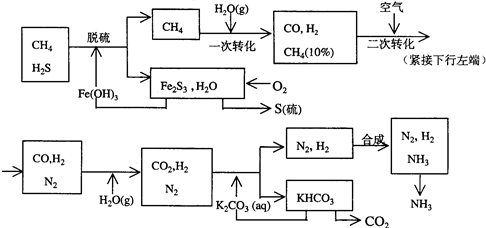
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
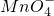 +Cu2S+H+=Cu2++SO2+Mn2++H2O(未配平).下列说法正确的是
+Cu2S+H+=Cu2++SO2+Mn2++H2O(未配平).下列说法正确的是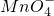 是氧化剂,既Cu2S是氧化剂又是还原剂
是氧化剂,既Cu2S是氧化剂又是还原剂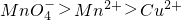
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用98%的浓H2SO4(ρ=1.84g/cm3)配制480mL0.5mol/L的稀H2SO4,请按要求填空:
用98%的浓H2SO4(ρ=1.84g/cm3)配制480mL0.5mol/L的稀H2SO4,请按要求填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com