
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)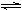 NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g) 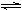 H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 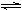 2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
(1)① k=[NH3] [HI] ② 正向 变浅(2) bd
(3)①27.78 ②0.05 ③0.15 ④正反应
(4)N2H4·2H2O [N2H5·H2O]+ + OH-
[N2H5·H2O]+ + OH-
解析试题分析:(1)①根据题给反应a结合平衡常数表达式的书写原则写出,反应a的平衡常数表达式为k=[NH3] [HI];②反应a是反应前后气体体积增大的反应,反应b是反应前后气体体积不变,所以增大容器体积相当于压强减小,平衡向气体体积增大的方向移动,所以平衡向正反应方向移动,因为容器体积增大,平衡时I2(g)的浓度减小,气体颜色变浅;(2)a.单位时间内生成2nmolNH3的同时消耗3nmolH2,同时生成3n molH2,该反应达到平衡状态,错误;b.当单位时间内生成6nmolN-H键同时消耗3nmolH-H键反应处于平衡状态,现同时生成2n molH-H键,则平衡向在反应方向移动,正确;c.反应处于任何状态,用N2、H2、NH3的物质的量浓度变化表示的反应速率之比均等于化学计量数之比,为1:3:2,不能确定该反应向正反应方向移动,错误;d.混合气体的平均摩尔质量增大,则平衡向气体体积减小的正反应方向移动,正确;e.混合气体质量不变,容器体积不变,所以容器内的气体密度始终不变,错误;选:bd;(3)①根据题给数据分析,反应进行到2 h时生成氨气0.6mol,结合题给热化学方程式计算放出的热量为27.78 kJ;②根据题给数据分析,0~1 h内N2的物质的量变化为0.1mol,根据公式v=Δn/VΔt计算,平均反应速率为0.05 mol·L-1·h-1;③根据题给数据分析,反应达到平衡后c(NH3)=0.5mol/L,c(N2)=0.5mol/L,c(H2)=1.5mol/L,化学平衡常数K=[NH3]2/[N2][H2]3=0.15;④反应达到平衡后,再加入N2、H2和NH3各1.00 mol,c(NH3)=1mol/L,c(N2)=1mol/L,c(H2)=2mol/L,浓度商Q=0.125<K,则平衡向正反应方向移动;(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱N2H4?2H2O,电离方程式为:N2H4?2H2O [N2H5?H2O]++OH-。
[N2H5?H2O]++OH-。
考点:考查化学平衡及弱电解质的电离平衡。


科目:高中化学 来源: 题型:填空题
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+
2NH3+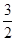 O2
O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
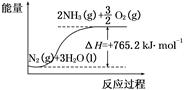
 2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四个反应:
| 反应 | A | B | C | D |
| ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | ½ | 0.1 |
| ⅱ | ________ | ________ | 5 |
| ⅲ | 350 | ________ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
298 K时,合成氨反应:N2(g)+3H2(g) 2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________
2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
300°C时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300°C时,该反应的平衡常数表达式为K=________。已知K300°C<K350°C,则ΔH________0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为_______,D的平均反应速率为_______。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”),原因是__________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各 mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________mol。
mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
t ℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)  2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)________。
| A.容器内压强不再发生变化 |
| B.SO2的体积分数不再发生变化 |
| C.容器内气体原子总数不再发生变化 |
| D.相同时间内消耗2n mol SO2的同时消耗n mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ、一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0。
FeO(s)+CO(g) ΔH>0。
(1)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强
C.充入一定量氮气 D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,使CO2的浓度成为原来的2倍,则CO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ、在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)  CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将 (填写“不变”、“变小”或“变大”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com