
废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2 和炭粉,用A制备高纯MnCO3,的流程图如下。
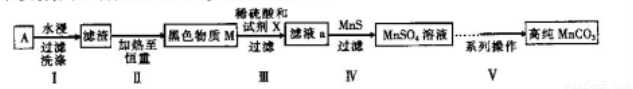
(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。 (已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5 g黑色物质M进行制备MnSO4的实验,得到数据如右表:
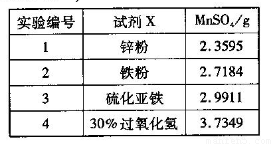
①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的
主要成分反应的化学方程式为_________。
(5)第V步系列操作可按以下流程进行:
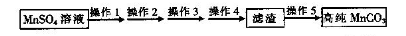
已知:MaCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH) 2开
始沉淀时pH为7.7。请补充完成以下操作:
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO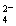 已除干净;? 操作4:___________________;
已除干净;? 操作4:___________________;
操作5:低温烘干。
(1)Zn
(2)除去碳和氯化铵
(3)Zn2++MnS= Zn2++MnS+Mn2+
(4)①30%过氧化氢???? ②MnO2+H2O2+H2SO4= MnSO4+2H2O+O2↑
(5)加入碳酸钠,控制pH小于7.7
用少量无水乙醇洗涤2——3次
【解析】
试题分析:(1)锌是活泼金属,电池反应中失去电子为负极;(2)加热灼烧碳生成二氧化碳除去,氯化铵分解除去,所以加热的目的是除去碳和氯化铵;(3)该反应是沉淀的转化,沉淀向溶度积小的物质转化,根据溶度积常数MnS不溶, ZnS更难溶;(4)①相同量的M实验4制备得到MnSO4的量最多,所以选用双氧水实验效果做好;②二氧化锰生成硫酸锰,化合价降低为氧化剂,所以双氧水为还原剂产物为氧气,MnO2+H2O2+H2SO4= MnSO4+2H2O+O2↑;(5)反应是制备碳酸锰,所以应加入碳酸钠等可溶性碳酸盐或碳酸氢盐,并调节pH小于7.7(防止生成氢氧化锰),生成碳酸锰,用水洗涤后沉淀表面有水在干燥时易被空气氧化,沉淀不溶于乙醇,且乙醇易挥发易于干燥,所以采用乙醇冲洗除去沉淀表面的水,一般操作2——3次。
考点:考查实验操作与原理有关问题。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH,见下表,回答下列问题:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
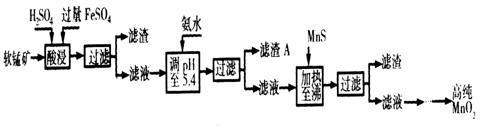
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_________________________________。
(2)滤渣A的主要成分为_________________。
(3)加入MnS的目的是除去____________________________杂质。
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为_____________________________。
(5)从废旧碱性锌锰干电池中可以回收利用的物质有_________________(写出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
![]()
![]()
![]()
![]()
![]() 某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)?3 | Fe(OH)?3 | Fe(OH)?2 | Mn(OH)?2 | Cu(OH)?2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
![]()
| 沉淀物 | Zn(OH)?2 | CuS | ZnS | MnS | FeS |
| pH | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
![]() (2)滤渣A的主要成分为 。
(2)滤渣A的主要成分为 。
![]() (3)加入MnS的目的是除去 杂质。
(3)加入MnS的目的是除去 杂质。
![]() (4)碱性锌锰干电池中,MnO2参与的电极反应方程式为 。
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为 。
![]() (5)从废旧碱性锌锰干电池中可以回收利用的物质有 (写出两种)。
(5)从废旧碱性锌锰干电池中可以回收利用的物质有 (写出两种)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省高三上学期9月阶段性检测化学试卷(解析版) 题型:填空题
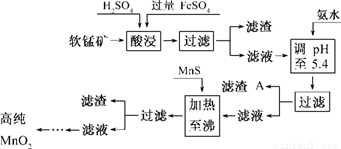
(7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%) 等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
pH |
|
Al(OH)3 |
5.2 |
|
Fe(OH)3 |
3.2 |
|
Fe(OH)2 |
9.7 |
|
Mn(OH)2 |
10.4 |
|
Cu(OH)2 |
6.7 |
|
Zn(OH)2 |
8.0 |
|
CuS |
≥-0.42 |
|
ZnS |
≥2.5 |
|
MnS |
≥7 |
|
FeS |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________________.
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com