
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下方法来制备这种材料并测定这种材料的组成:
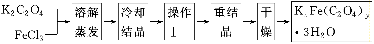
(1)结晶时应将溶液用冰水冷却置于在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________________。
(2)操作Ⅰ的名称是______________________。
(3)称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.100 0 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00 mL时恰好完全反应,H2C2O4与酸性KMnO4溶液反应的化学方程式是:__________________________。再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定。当Fe2+完全氧化时,用去KMnO4溶液4.00 mL,此滴定反应的离子方程式是____________。
(4)配制100 mL 0.100 0 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________(填仪器名称)。滴定终点时溶液颜色为________色,且30秒内不变色。
(5)经计算,化合物KxFe(C2O4)y·3H2O中,x=________。
(1)用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解
(2)过滤、洗涤
(3)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O MnO+5Fe2++8H+=Mn2++5Fe3++4H2O
(4)100 mL容量瓶、酸式滴定管 (紫)红
(5)3
【解析】(1)用冰水冷却,可使溶液的温度下降,降低了晶体的溶解度,便于更多晶体的析出;在暗处可防止晶体见光分解。
(2)操作Ⅰ是将晶体的溶液分离,故为过滤、洗涤。
(3)酸性KMnO4溶液氧化H2C2O4的化学方程式为为:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O;酸性KMnO4溶液氧化Fe2+的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
(4)配制100 mL KMnO4溶液,需用100 moL容量瓶,滴定时操作时KMnO4溶液盛装于酸式滴定管中。
(5)n(C2O42-)=n(H2C2O4)=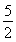 n(KMnO4)=
n(KMnO4)= ×0.1 mol/L×24×10-3 L=6×10-3 mol,
×0.1 mol/L×24×10-3 L=6×10-3 mol,
n(Fe3+)=5n(KMnO4)=5×0.1 mol/L×4×10-3 L=2×10-3 mol
n(Fe3+)∶n(C2O42-)=1∶y=2×10-3∶6×10-3=1∶3,y=3,由化合价代数和为零的原则可得:
x×(+1)+(+3)×1+(-2)×3=0
解得x=3,


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
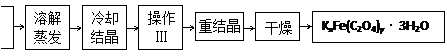 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:_________________
_______________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
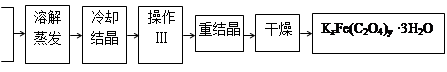 Ⅰ.制备
Ⅰ.制备
K2C2O4
FeCl3
(1)结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:__________________。
(2)操作Ⅲ的名称是___________ 。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。第二次滴定的离子化学方程式为:
__________________________ ___ __________________________
(3)配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。
(4)该化合物KxFe(C2O4)y·3H2O中,x=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4)y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省杭州第二中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期化学一轮复习《化学家眼中的物质世界》专题综合测试(苏教版) 题型:填空题
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O

材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com