
[2012·北京石景山一模](10分)我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
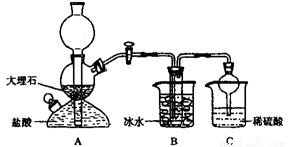
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
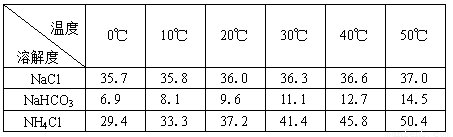
参照表中数据,请分析B装置中使用冰水的目的是 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:2013届新课标高三配套月考(一)化学试卷(A卷)(带解析) 题型:实验题
[2012·北京石景山一模](10分)我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。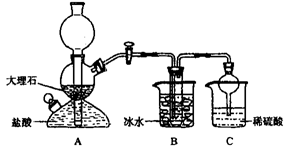
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)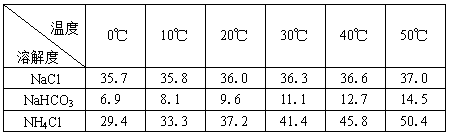
参照表中数据,请分析B装置中使用冰水的目的是 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(二)化学试卷(A卷)(解析版) 题型:推断题
[2012·北京怀柔一模](11分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
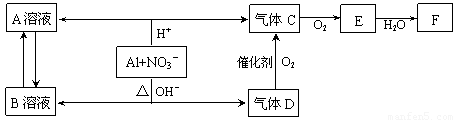
已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式 。
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式 。
(3)完成并配平下列离子方程式:Al+NO3-+OH-+H2O— + 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)。
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(二)化学试卷(A卷)(解析版) 题型:填空题
[2012·北京大兴一模](11分)下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(一)化学试卷(B卷)(解析版) 题型:实验题
[2012·北京朝阳一模](12分)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是____ ____。
(2)步骤②反应的离子方程式是_____ ___。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为___ _____。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。
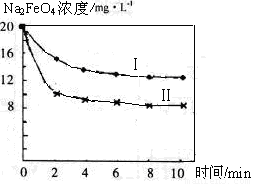
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是____ _
(答出两点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com