
| A. | 质子数c>b | B. | 离子的还原性Z->Y2- | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
分析 离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子序数a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子序数a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素.
A.由以上分析可知c=8,b=11,则质子数c<b,故A错误;
B.非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性Y2->Z-,故B错误;
C.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HZ>H2Y,故C错误;
D.W为Al元素,X为Na元素,原子半径Na>Al,故D正确,
故选D.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:多选题
| A. | 10g H2 和10g O2 | B. | 5.6lL N2(标准状况下)和11gCO2 | ||
| C. | 9克H2O和0.5mol 02 | D. | 224mL H2(标准状况下)和0.1mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体--原未知试液中一定含有NH4+ | |
| B. | 在某未知试液中加入硝酸银溶液,产生白色沉淀--原未知试液中一定含有Cl- | |
| C. | 用洁净的铂丝蘸取某溶液,置于火焰上灼烧,观察到火焰呈黄色--原溶液中一定含有Na+,不含有K+ | |
| D. | 在某未知试液中滴加过量的稀盐酸得到澄清溶液,再往澄清溶液中加入BaCl2溶液得白色沉淀--原未知试液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目
在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)用轨道示意图表示Fe3+的价电子排布
(1)用轨道示意图表示Fe3+的价电子排布 .
.| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质中只含一种元素,所以只含一种元素的物质一定是单质 | |
| B. | 化学变化前后物质的质量总和不变,所以1g H2和1g O2一定能够生成2g H2O | |
| C. | 碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的物质一定呈碱性 | |
| D. | 中和反应有盐和水生成,所以有盐和水生的反应一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

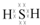 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应 | 离子方程式 | 评价 |
| A | 亚硫酸钡与盐酸反应 | BaSO3+2H+═Ba2++SO2↑+H2O | 正确 |
| B B | 向NaHSO4溶液中逐滴加入Ba(OH)2至溶液呈中性 | H++SO42-+Ba2++OH-═BaSO4+H2O | 正确 |
| C C | 铝制易拉罐去膜后放入NaOH溶液中 | 2Al+2OH-═2AlO2-+H2↑ | 错误,方程式未配平 |
| D | 少量铁粉与稀硝酸反应 | 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 错误,少量铁粉与稀硝酸反应应生成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com