
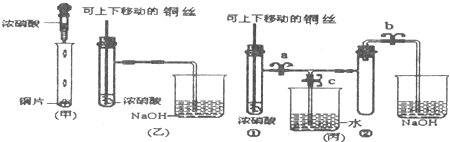
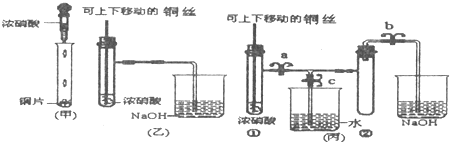
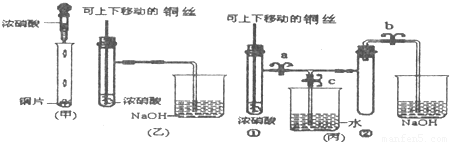
铜与硝酸反应的化学方程式为:
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
解析:从绿色化学角度评价上述三个实验方案要考虑两点:
(1)节约原料;
(2)副产品对环境污染小。
(甲)Cu+4HNO3(浓) ====Cu(NO3)2+2NO2↑+2H2O
(乙)3Cu+8HNO3(稀) ====3Cu(NO3)2+2NO↑+4H2O
(丙)2Cu+O2![]() 2CuO,CuO+2HNO3====Cu(NO3)2+H2O。
2CuO,CuO+2HNO3====Cu(NO3)2+H2O。
若生成3 mol Cu(NO3)2,列下表比较消耗原料量及生成污染物的量即得答案。
| Cu(NO3)2 | Cu | HNO3 | NOx |
(甲) | 3 mol | 3 mol | 12 mol | 6 mol |
(乙) | 3 mol | 3 mol | 8 mol | 2 mol |
(丙) | 3 mol | 3 mol | 6 mol | 0 |
答案:(甲)方案耗HNO3最多,生成污染物最多;(丙)方案耗HNO3最少,没有污染环境的气体产生。故丙方案最好,甲方案最差。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2009年天津市红桥区高考化学一模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com