
| A. | SO2和NaOH | B. | CO2和H2O | C. | Cl2和O3 | D. | CCl4和KCl |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,同种非金属元素之间形成非极性共价键、不同非金属元素之间形成极性共价键,据此分析解答.
解答 解:A.SO2中硫和氧之间只共价键,NaOH中钠离子和氢氧根离子之间存在离子键、氧原子和H原子之间存在共价键,所以化学键类型不同,故A错误;
B.H2O是H原子和O原子之间存在极性键,CO2中O原子与碳原子之间存在极性键,所以化学键类型相同,故B正确;
C.Cl2中氯与氯之间存在非极性共价键,O3中氧与氧之间存在非极性共价键,所以化学键类型相同,故C正确;
D.KCl中K离子和Cl离子之间存在离子键、CCl4中C原子和Cl原子之间存在共价键,所以化学键类型不同,故D错误;
故选BC.
点评 本题考查了化学键的判断,根据物质的构成微粒及微粒间的作用力来分析解答,知道离子键、共价键的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
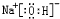 、
、 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象 | |
| B. | 取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象 | |
| C. | 取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化 | |
| D. | 取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CH3COO- | ||
| C. | Na+、NH4+、NO3-、S2- | D. | Na+、Ag+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Cu2+ | |
| B. | 在pH=1的溶液中:Fe2+、Mg2+、NO3-、ClO- | |
| C. | c(H+)=10-12 mol•L-1的溶液:Na+、S2-、AlO2-、SO32- | |
| D. | 使石蕊试液变红的溶液:K+、NH4+、I-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
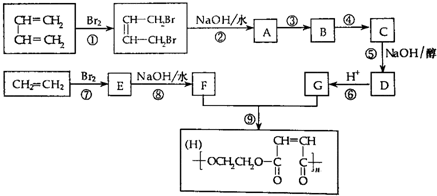
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com