
【题目】标准状况下H2和O2各1mol,它们的
A. 体积不同,质量相同 B. 体积不同,分子数相同
C. 体积相同,质量不同 D. 体积相同,原子数不同
科目:高中化学 来源: 题型:
【题目】铁的化合物在工业上有重要的应用.
(1)FeCl3净水的原理是(用离子方程式表示)_________________.FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________________.
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2废液得到FeCl3.
①若酸性FeCl2废液中c(Fe2+)=2.0×10﹣2molL﹣1,c(Fe3+)=1.0×10﹣3molL﹣1,c(Cl﹣)=5.3×10﹣2molL﹣1,则该溶液的PH约为_____.
②完成NaClO3 氧化FeCl2 的离子方程式:
ClO3﹣ +___Fe2+ +___ ____= __Cl﹣ + ___Fe3++ __ ____.
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如图1所示:反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明__________________________.某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO﹣与ClO3﹣离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为_____.
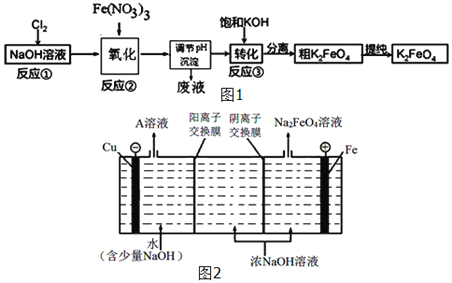
(4)工业上还可用通过电解浓NaOH溶液来制备Na2FeO4,其工作原理如图2所示:阳极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法正确的是()
A.除去溴苯中混有的少量溴单质:加入足量的氢氧化钠溶液,振荡静置分液
B.除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀
C.除去乙醇中的微量水,可加入金属钠,使其完全反应
D.除去乙酸乙酯中的乙酸,加入碳酸钠溶液洗涤,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需加入还原剂的是 ( )
A. HCO3-→CO2 B. MnO4-→Mn2+ C. FeO→Fe3O4 D. H3AlO3→HAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铁溶液中,加入a g铜完全溶解后再加入b g铁,充分反应后得到c g残余固体,且a>c,则下列说法中正确的是( )
A. 残余固体可能为铁和铜的混合物 B. 最后得到的溶液可能含有Fe3+
C. 最后得到的溶液中一定含有Fe2+,可能含有Cu2+ D. 残余固体一定全部是铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写错误的是( )
A. 在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO42-+4H+
B. 饱和Na2CO3溶液中通入CO2足量:2Na++CO32-+ CO2+H2O=2NaHCO3↓
C. 向酸性KMnO4溶液中加入H2O2:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D. 钠投入CuSO4溶液中:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在无色溶液中能大量共存的是( )
A. Fe3+、NH4+、OH-、Cl- B. Na+、H+、NO3-、SO42-
C. Fe2+、Fe3+、Na+、NO3- D. Fe2+、NH4+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的钠、镁、铝分别与足量盐酸反应,产生H2的质量由大到小排列顺序正确的
A.Al、Mg、Na B.Mg、Al、Na C.Na、Mg、Al D.Na、Al、Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com