
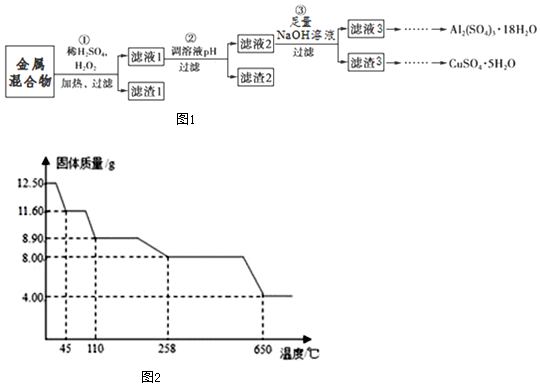
分析 Cu、Fe、Al、Au、Pt的金属混合物中加入硫酸和H2O2的混合物溶解,可以得到滤液1为铁盐、铝盐、铜盐溶液,滤渣1为Au、Pt,滤液1调节pH使铁离子沉淀,过滤分离出滤渣2为氢氧化铁,再向滤液2中加入过量的NaOH溶液,过滤得滤液3为偏铝酸钠溶液,再通入过量的二氧化碳气体,生成氢氧化铝沉淀,过滤向沉淀中加稀硫酸,结晶得Al2(SO4)3•18H2O;滤渣3为Cu(OH)2,加硫酸溶解后,蒸发浓缩,冷却结晶,过滤、洗涤,即得到硫酸铜晶体;
根据加热过程中,硫酸铜晶体分步失去结晶水,所以前三段为失去结晶水的过程,最后一段,硫酸铜粉末就会发生分解,生成黑色金属氧化物氧化铜、二氧化硫及氧气,据此分析解答.
解答 解:(1)过滤操作所用到的玻璃仪器有烧杯、玻璃棒和漏斗,故答案为:玻璃棒;
(2)在金属混合物与硫酸和H2O2的反应中,铜与硫酸和H2O2在加热条件下反应生成硫酸铜和水,离子方程式为Cu+H2O2+2H+═Cu2++2H2O,铁也被氧化生成Fe3+,铝生成Al3+,所以此时该溶液中所有的金属阳离子是Cu2+、Fe3+、Al3+;根据以上分析步骤②中得到滤渣2的主要成分是Fe(OH)3,故答案为:Cu+H2O2+2H+═Cu2++2H2O;Cu2+、Fe3+、Al3+;Fe(OH)3;
(3)根据以上分析,滤渣3为Cu(OH)2,加硫酸溶解后,蒸发浓缩,冷却结晶,过滤、洗涤,即得到硫酸铜晶体;滤液3为偏铝酸钠溶液,再通入过量的二氧化碳气体,生成氢氧化铝沉淀,过滤向沉淀中加稀硫酸,结晶得Al2(SO4)3•18H2O,故答案为:冷却结晶;④②;
(4)在步骤(3)中,加入过量的NaOH溶液,发生反应的第一个离子方程式为Al3++4OH-═AlO2-+2H2O,故答案为:Al3++4OH-═AlO2-+2H2O;
(5)加热过程中,硫酸铜晶体分步失去结晶水,所以前三段为失去结晶水的过程,最后一段,硫酸铜粉末就会发生分解,生成黑色金属氧化物氧化铜、二氧化硫及氧气;
则由图示数据可知,结晶水的质量为:12.50g-8.0g=4.5g
CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O↑.
160+18x 18x
12.50g 4.5g
160+18x=50x
解得x=5;
258℃到650℃时,最后一段,硫酸铜粉末就会发生分解,生成黑色金属氧化物氧化铜、二氧化硫及氧气,反应方程式为:2CuSO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2↑+O2↑,故答案为:5;2CuSO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2↑+O2↑.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程及物质组成、性质、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;Y的价电子轨道表示式为
;Y的价电子轨道表示式为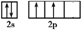 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类.油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 适量饮用矿泉水对身体健康有益 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液的物质的量浓度为1 mol.L-1 | |
| B. | 所得溶液中含有NA个HCl分子 | |
| C. | 36.5 g HCl气体占有的体积为22.4 L | |
| D. | 所得溶液的质量分数:w=$\frac{36.5c}{1000ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对原子(分子)质量 | |
| B. | 物质的量是国际单位制中的一个基本单位 | |
| C. | 0.012㎏12C中所含的碳原子数为NA | |
| D. | 1mol任何物质都含有NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液的PH=7 | B. | 混合溶液中,C(H+)=$\sqrt{Kw}$mol•L-1 | ||
| C. | a=b | D. | 混合溶液中,C(H+)+C(B+)=C(OH-)+C(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、NO3-、K+、Na+ | B. | H+、Fe3+、SO42-、Cl- | ||
| C. | K+、Cu2+、Cl-、CO32- | D. | Al3+、Fe2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHClCH2CH3 | B. | CH3CHBrCH3 | C. | 新戊烷 | D. | CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com