
下列说法正确的是
A.SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同
B.浓硫酸具有强氧化性,稀硫酸不具有氧化性
C.用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体
D.明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同
科目:高中化学 来源: 题型:
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO )
)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
A.全部 B.③⑤⑥
C.④⑤⑥ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
根据四种变化:①Fe(s)→Fe(g); ②2H2(g)+ O2(g)=2H2O(g) △H=-482 kJ·mol-1
③C(s)+CO2(g)=2CO(g) ; ④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 ▲ (请填变化的代码①②③④,下同)
⑵上述变化中,体系的混乱度增大的是 ▲ 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 ▲ kJ的能量。
⑷下面几种说法中。正确的是 ▲
A.化合反应都大多是放热反应
B.凡是需要加热的反应,都是吸热反应
C.体系的混乱度增大的反应都是吸热反应
D.中和反应是放热反应,其化学能可以转化成电能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,回答有关问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ⑴ | ⑵ | ||||||
| 三 | ⑶ | ⑷ | ⑸ | ⑹ | ⑺ | ⑻ | ⑼ | |
| 四 | ⑽ | ⑾ | ⑿ |
(1)写出下列元素符号:⑴ ,⑹
(2)在这些元素中,最不活泼的元素的结构示意图是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为 ;碱性最强的与呈两性的发生反应的离子方程式为 .
(4)在⑵⑶⑻⑽这些元素简单离子中,离子半径由大到小的顺序是 (填离子符号)
(5)元素⑻、⑾和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有 。(2分)
(6)用电子式表示由元素(8)和(10)形成化合物的过程: 。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
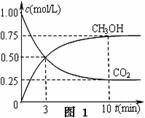
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为
mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
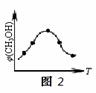
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) | 91︰9 | 1︰1 | 9︰91 |
| pH | 8.2 | 7.2 | 6.2 |
① 由上表判断,NaHSO3溶液显 性, 用化学平衡原理解释: 。
② 当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是( )
A.CH3COOH +H2O  CH3COO- + H3O+
CH3COO- + H3O+
B.SO2 + H2O  HSO3- + H+
HSO3- + H+
C.HS- + H2O  S2- + H3O+
S2- + H3O+
D.CO32- + H2O  HCO3- + OH-
HCO3- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子 A2+,B+,C3-,D- 都具有相同的电子层结构,则下列叙述正确的是
A.单质的还原性A>B>D>C B.原子序数D>C>B>A
C.原子半径A>B>D>C D.离子半径C>D>B>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com