
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
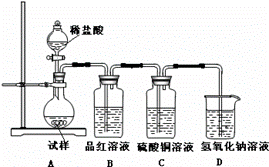
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量, 在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl—外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原 因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。
科目:高中化学 来源: 题型:
不能作为判断硫、氯两种元素非金属性强弱的依据是 ( )
A. 单质氧化性的强弱 B. 氢化物沸点的高低
C. 氢化物还原性强弱 D. 最高价氧化物对应的水化物酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是 ( )
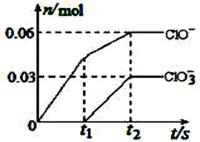
A.苛性钾溶液中KOH的物质的量是0.09mol
B.ClO3-的生成是由于氯气的量的多少引起的
C.在酸性条件下ClO-和ClO3-可生成Cl2
D.反应中转移电子的物质的量是0.21mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2。将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是 ( )
A.V=2.24L
B.参加反应的HCl为0.18mol
C.无法确定最终生成含钾化合物的数量是多少
D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列关于0.2mol·L-1的Ba(NO3)2溶液的说法不正确的是
A.2L溶液中有阴、阳离子总数为1.2NA
B.500mL溶液中NO3-离子浓度为0.2mol·L-1
C.500mL溶液中Ba2+离子浓度为0.2mol·L-1
D.500mL溶液中NO3-离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度最大的是( )
|
| A. | 200mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5mol/L NaCl溶液 |
|
| C. | 250mL 1.5mol/L AlCl3溶液 | D. | 300mL 3mol/LKCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应
2SO2(g)+O2(g) 2SO3(g) ∆H=-196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=-196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
下列说法不正确的是( )x*k.
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 ·min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.该温度,反应的平衡常数为11.25L·mol-1
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com