
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化铜与盐酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.石灰石与硝酸反应;大理石与盐酸
D.Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液
科目:高中化学 来源:2016届四川省广元市高三上学期第二次阶段测理综化学试卷(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
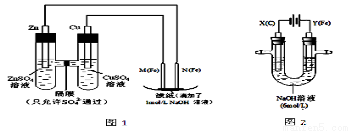
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;
滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。电解过程中,Y极发生的电极反应为Fe-6e-+8OH-==FeO42-+4H2O 和 。
(5)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
、N2H2是一种高效清洁的火箭燃料。0.25 mol N2H2(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式正确的是
A.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH=+133.5 kJ·mol-1
B.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH=-133.5 kJ·mol-1
C.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH=+534 kJ·mol-1
D.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省许昌、襄城、长葛三校高一上期中测试化学试卷(解析版) 题型:填空题
I.按要求写出对应反应的离子方程式:
(1)硫酸镁溶液与氢氧化钡溶液反应 ;
(2)用氢氧化钠溶液出去CO中少量的 CO2气 ;
(3)用稀硫酸除去铁钉上的铁锈(主要成分是Fe2O3) ;
II.以下8种为中学化学中常见的物质:
①CaO ②H2O ③胆矾 ④CaCO3 ⑤H2SO4 ⑥氨水 ⑦酒精 ⑧Cu
请按下列分类标准回答问题:
(1)属于电解质的是 (2)属于盐的是
(3)属于氧化物的是 (4)属于非电解质的是
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省宜宾市高二上学期期中测试化学试卷(解析版) 题型:选择题
已知下列三个数据:7.1×10-4 mol·L-1、6.8×10-4 mol·L-1、6.2×10-10 mol·L-1分别是三种酸的电离平衡常数。若这三种酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2 ②NaCN+HF=HCN+NaF ③ NaNO2+HF=HNO2+NaF
则下列叙述中不正确的是
A.HF的电离平衡常数为7.1×10-4 mol·L-1
B.HNO2的电离平衡常数为6.2×10-10 mol·L-1
C.根据①③两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN的大,比HF的小
查看答案和解析>>
科目:高中化学 来源:2016届湖北省老河口市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.羟基跟链烃基直接相连的化合物属于醇类
B.含有羟基的化合物属于醇类
C.酚类和醇类具有相同的官能团,因而具有相同的化学性质
D.分子内含有苯环和羟基的化合物都属于酚类
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:填空题
在一个2L的密闭容器中,发生反应2SO3(g) 2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:
2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:

(1)写出该反应的平衡常数表达式_______________ 。
(2)用O2表示0~8min内该反应的平均速率v= 。
(3)升高温度, K值将 ;容器中气体的平均相对分子质量将 。(填“增大”“减小”或“不变”)
(4)从8min起,压缩容器为1L,则SO3的变化曲线为
A.a B.b C.c D.d
(5)计算该温度下的平衡常数K=
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com