


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:不详 题型:单选题
| A.向其中放入过量镁条,反应完毕后取出 |
| B.蒸馏 |
| C.加入能氧化I2的KMnO4,再分液 |
| D.通入氯气 |
查看答案和解析>>
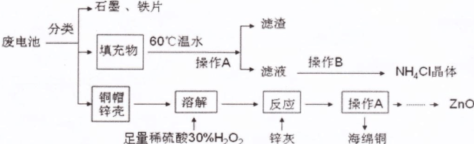
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
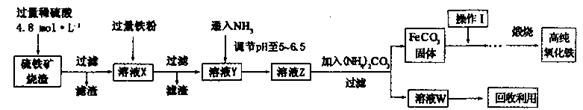
科目:高中化学 来源:不详 题型:实验题
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入______ | 无现象 | 证明不是以IO3ˉ形式存在 |
| ③ | 往试管II中加入_______ | _______________ | 证明以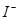 形式存在 形式存在 |
查看答案和解析>>
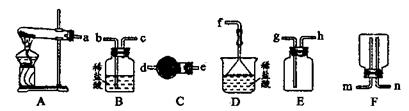
科目:高中化学 来源:不详 题型:计算题
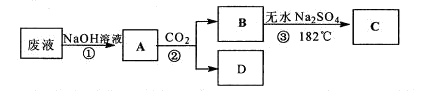
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
查看答案和解析>>
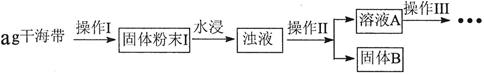
科目:高中化学 来源:不详 题型:实验题
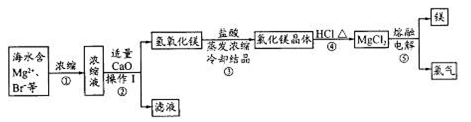
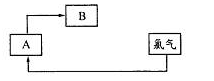
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②①③④⑤ | B.①②③④⑤ | C.②③①④⑤ | D.②③①④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
| 甲醇 | 64. 7 |  | 0. 7915 | 易溶于水 |
| 乙醚 | 34. 5 |  | 0. 7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 |  | 33 ~36 |  | 易溶于甲醇、乙醚,微溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com