
【题目】下列各关系中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A.3molH—H键断裂的同时有6molN—H键形成
B.c(H2)与c(NH3)保持相等
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:反应①O3![]() O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3
O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3![]() 2O2ΔH<0平衡常数为K2;总反应:2O3
2O2ΔH<0平衡常数为K2;总反应:2O3![]() 3O2ΔH<0衡常数为K。下列叙述正确的是( )
3O2ΔH<0衡常数为K。下列叙述正确的是( )
A.升高温度,K增大B.K=K1+K2
C.适当升温,可提高消毒效率D.压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,将达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,将达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应的图象符合的是( )
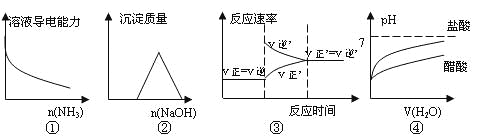
A.①是向一定量的CH3COOH溶液中通入氨气
B.②是向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.③是对于达到平衡状态的![]() 反应,在t1时缩小容器,并在t2时又达到平衡。
反应,在t1时缩小容器,并在t2时又达到平衡。
D.④是将pH=2的盐酸和醋酸分别加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 下,将m
下,将m![]() 的醋酸溶液与n
的醋酸溶液与n![]() 的氢氧化钠溶液等体积混合,恰好使反应后的溶液呈中性,则下列观点正确的是
的氢氧化钠溶液等体积混合,恰好使反应后的溶液呈中性,则下列观点正确的是
A.反应后的溶液中:![]()
B.反应前溶液的物质的量浓度:![]()
C.反应后的溶液中:![]()
![]()
D.该温度下,醋酸的电离平衡常数的表达式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是( )

A.NH4HCO3溶液中存在下列守恒关系:c(NH![]() )+c(NH3·H2O)=c(HCO
)+c(NH3·H2O)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH![]() 和HCO
和HCO![]() 浓度逐渐减小
浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO![]() )>c(NH
)>c(NH![]() )>c(NH3·H2O)>c(CO
)>c(NH3·H2O)>c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
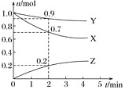
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com