
(1)1 mol分子式为C3H8O的液体有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A的分子式必有一个__________基。若A分子中只有一个—CH3,完成(2)(3)中的填空:
(2)A与浓硫酸共热,分子内脱去1分子水,生成B。B的结构简式为__________。B通入溴水能发生__________反应生成C,C的结构简式为__________。A在有铜作催化剂时,与氧气一起加热,发生氧化反应,生成D,D的结构简式为__________。
(3)写出下列反应的化学方程式:
①A―→B_____________________________________________;
②B―→C_____________________________________________;
③A―→D_____________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列离子方程式表达正确的是( )
A.SO2通入溴水中:SO2+2H2O+Br2===4H++SO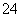 +2Br-
+2Br-
-B.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO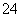 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
C.漂白粉在空气中失效:ClO-+CO2+H2O===HClO+HCO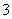
 D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是( )
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于醇的物理性质的说法中正确的是( )
A.“酒香不怕巷子深”的说法说明了乙醇容易挥发
B.所有的醇在常温下均为液态
C.醇类物质都易溶于水,并且随着分子内羟基数目的增多,溶解性增强
D.由于醇分子中存在氢键,使得相对分子质量相近的醇比烷烃的熔沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物甲经过下列两个反应可获得化合物丙:C4H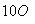
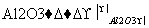
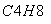
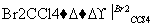
 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )
A.CH3CH(CH2Br)2 B.(CH3)2CBrCH2Br
C.C2H5CHBrCH2Br D.CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF)
C.c(OH-)>c(HF) D.c(HF)>c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O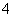 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10
10C+P4O10===P4(白磷)+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O===□Ce(OH)4↓+□________。
解析:(1)反应过程中磷酸钙最终变成了白磷,磷的化合价由+5价变成0价,由此可以得到 如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
(2)分析反应可知,C e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com