
元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)写出⑦元素名称_____,画出⑥的离子结构示意图__________;写出②含有10个中子的核素的化学符号_________。
(2)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为_______________。(用化学式表示,下同)
(3)②③⑥元素氢化物的稳定性由强到弱的顺序为________(填化学式)。
(4)请写出①的氢化物发生催化氧化的化学方程式_______________________________。
(5)表中能形成两性氢氧化物的元素是_______(填元素符号),写出该元素的氧化物与⑧的最高价氧化物的水化物反应的离子方程式____________________________
(6)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应____________________________________.
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2016-2017学年安徽省六安市高一下学期第一次阶段检测化学试卷(解析版) 题型:选择题
香烟烟雾中含有CO、CO2、SO2、H2O等气体。用a无水硫酸铜、b澄清石灰水、c红热氧化铜、d生石灰、e品红溶液等可将其一一检出,检出的正确顺序是
A.混合气→a→e→e→b→d→c
B.混合气→c→d→e→e→a
C.混合气→a→e→b→a→d→c
D.混合气→b→e→a→d→c
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(一)化学试卷(解析版) 题型:实验题
三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·H2O可用于摄影和蓝色印刷。某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液V1ml,滴定中MnO4-,被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液V2mL。
(1)加入锌粉的目的是____________
(2)实验步骤二中加KMnO4的溶液的离子方程式为______________
查看答案和解析>>
科目:高中化学 来源:2017届北京市朝阳区高三第一次(3月)综合练习理综化学试卷(解析版) 题型:填空题
我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工作流程如下:
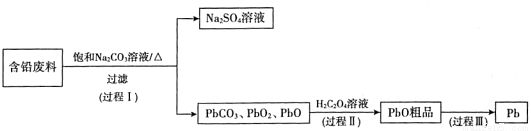
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见图2。
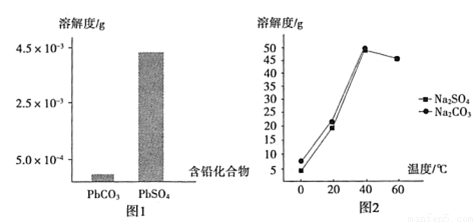
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释可能原因:
i.温度降低,反应速率降低; ii.____(请你提出一种合理解释)。
③若生产过程中温度低于40℃,所得固体中,含有较多Na2SO4杂质,原因是____。
(3)过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是____。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图3。

①阴极的电极反应式是____________。
②电解一段时间后,PbCl2'浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
查看答案和解析>>
科目:高中化学 来源:2017届北京市朝阳区高三第一次(3月)综合练习理综化学试卷(解析版) 题型:选择题
下列有关性质的比较,不能用元素周期律解释的是
A. 金属性:Na>Mg B. 酸性:H2SO4>H2SiO3
C. 稳定性:HCl> HBr D. 同浓度溶液的碱性:Na2CO3> NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一下学期第一次月考(3月)化学试卷(解析版) 题型:选择题
下列实验不能作为判断依据的是( )
A.钠和镁分别与冷水反应,判断钠和镁金属性强弱
B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱
C.硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一下学期第一次月考(3月)化学试卷(解析版) 题型:选择题
用铝热法还原下列化合物,制得金属的物质的量各 1 mol,需消耗铝最少的是
A.MnO2 B.Co3O4 C.WO 3 D.Cr2O3
3 D.Cr2O3
查看答案和解析>>
科目:高中化学 来源:四川省成都市北湖校区2016-2017学年高一3月月考化学试卷 题型:选择题
己知短周期元素的四种离子:aA3+、bB+、。C2-、dD-都具有相同的电子层结构,则下列叙述中正确的是( )
A. 原子序数d>c>b>a B. 单质的还原性D<C<B<A
C. 离子半径C2->D->B+>A3+ D. 离子的氧化性A3+<B+
查看答案和解析>>
科目:高中化学 来源:2017届高考信息卷(全国卷I)理科综合(一)化学试卷(解析版) 题型:填空题
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | …… |
Ia(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
则该元素是_______(填写元素符号)。
(2)基态C原子中,电子运动状态有_____种,电子占据的最高能级符号为_____,该能级含有的轨道数为________。
(3)关于化合物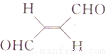 ,下列叙述正确的有______。
,下列叙述正确的有______。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D. C原子的杂化方式是sp2和sp3
(4)已知苯酚(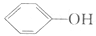 )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子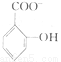 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_____Ka(苯酚)(填“>”或“<”),其原因是____________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_____Ka(苯酚)(填“>”或“<”),其原因是____________。
(5)在硅酸盐中,SiO44-四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根的一部分;Si与O的原子数之比为______,化学式为_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com