
信息、材料、能源被称为新科技革命的“三大支柱”。下列观点或做法错误的是
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机 |
| C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅 |
| D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机 |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:单选题
指常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是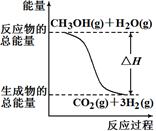
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ?ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ?ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
| A.反应①中的能量变化如右图所示 |
| B.CH3OH转变成H2的过程一定要吸收能量 |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.可推知2H2(g)+O2(g)=2H2O(g)??H=-483.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H =" -57.3" kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式: 2H2O(l)=2H2(g)+O2(g)△H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g)△H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法错误的是( )
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 |
| B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用50mL0.50mol/L盐酸50mL0.50mol/LNaOH测得的数值准确 |
| C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
| D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+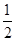 O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
| A.-1 780 kJ/mol | B.-1 220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s);△H=-2834.9kJ?mol-1
②4Al(s)+2O3(g)=2Al2O3(s);△H=-3119.1kJ?mol-1 由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.反应①可确定铝的燃烧热是708.7KJ |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.反应②可确定铝的燃烧热是779.78 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) 2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
| A.H-H比N≡N更牢固 |
| B.N≡N键能约为946 kJ/mol |
| C.合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com