
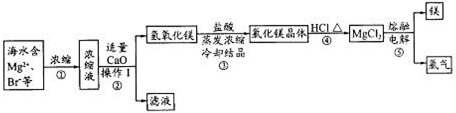
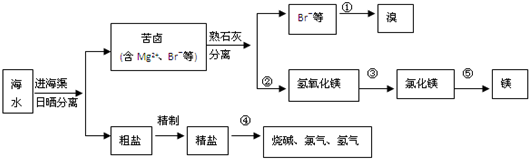
海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:
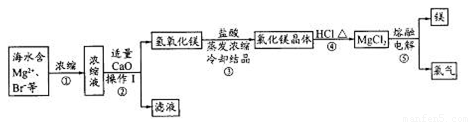
根据上述流程图,回答下列问题:
(1)操作I的名称是 。
(2)步骤中②反应的化学方程式为 。
(3)步骤④中加热时通入HCl气流的作用是 。
(4)步骤⑤的离子反应方程式为 。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为 。
(1)过滤(1分)
(2)CaO+H2O=Ca(OH)2(1分) MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) (1分)
(3)增大HCl浓度抑制MgCl2的水解(1分)
(4)Mg2++2Cl- Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
(5)滤液(或浓缩液) Br2(2分,各1分)
【解析】
试题分析:
海水中主要有Na+,Cl-,Mg2+,Br-, SO42-等离子,蒸发浓缩后取浓缩液加CaO后会产生Mg(OH)2↓,进行过滤,滤液中当然含有Na+,Cl-,Br-, SO42-等离子。取所得的Mg(OH)2加HCl后进行浓缩结晶得到MgCl2晶体。再在HCl氛围中加热使其失去结晶水,得到MgCl2后,在进行电解得到Mg和Cl2。
(1)将固体和液体分开采用过滤(2)步骤中②反应的化学方程式为CaO+H2O=Ca(OH)2
MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(3)步骤④中加热时通入HCl增大HCl浓度,在HCl氛围中,抑制MgCl2的水解,不能直接加热,否则MgCl2晶体会发生水解得到Mg(OH)2(4)步骤⑤的离子反应方程式为Mg2++2Cl- Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2
Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2
考点:物质的分离与提纯(水解,离子方程式书写,实验操作等)


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
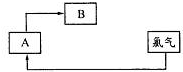
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com