
分析 (1)该溶液中c(H+)=0.1mol/L×0.1%=10-4 mol/L,pH=-lgc(H+);
(2)该溶液中HA电离出的c(H+)=10-4 mol/L,水电离出的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L;
(3)HA电离平衡常数Ka=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$;
(4)弱电解质的电离是吸热反应,升高温度促进弱电解质电离,溶液中氢离子浓度增大.
解答 解:(1)该溶液中c(H+)=0.1mol/L×0.1%=10-4 mol/L,pH=-lgc(H+)=-lg10-4=4,
故答案为:4;
(2)该溶液中HA电离出的c(H+)=10-4 mol/L,水电离出的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,所以由HA电离出的c(H+)与水电离出的c(H+)比=10-4 mol/L:10-10mol/L=106,
故答案为:106;
(3)HA电离平衡常数Ka=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=10-7,故答案为:10-7;
(4)弱电解质的电离是吸热反应,升高温度促进弱电解质电离,所以电离平衡常数增大,溶液中氢离子浓度增大,溶液的pH减小,故答案为:增大;减小.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点是解本题关键,易错点是水电离出c(H+)的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液、氯水 | B. | 稀盐酸、KMnO4溶液 | ||
| C. | 稀硫酸、KMnO4溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
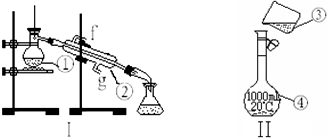
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
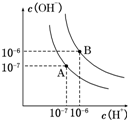 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠跟冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,将0.10mol•L-1盐酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1盐酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | N点所示溶液中c(NH4+)>c(Cl-) | |
| C. | Q点消耗盐酸的体积等于氨水的体积 | |
| D. | M点和N点所示溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、K+、Ba2+、Cl- | B. | Na+、K+、Cl-、S2- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Na+、SO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com