
【题目】I.某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去,
方案②:B中加入KSCN溶液,溶液不变血红色,再加入新制的氯水,溶液变血红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
(1)上述实验方案中能证明该反应液有Fe2+生成的是_____________。
Ⅱ.氨气具有还原性,在加热时与氧化铜发生反应的化学方程式为:2NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
某化学实验小组拟用下列仪器(可重复使用)证明氨气具有还原性,并检验生成的水。现提供浓氨水、氧化铜,若需其他试剂可自选。(连接和固定仪器用的胶管、铁夹、铁架台等装置均略去),请回答下列问题:

(2)上述仪器从左到右的连接顺序是__→D→__→D→__(填字母)。____________
(3)烧瓶中加入的固体试剂可以是___。
①生石灰 ②五氧化二磷 ③硫酸铜 ④氢氧化钠
(4)装置C中倒扣漏斗的作用是__________________。
(5)需重复使用的仪器D中所选用的固体药品依次是_____。
(6)实验中证明有水生成的现象是_______________________________
【答案】② B A C ①④ 防止倒吸 生石灰或碱石灰 无水硫酸铜 白色粉末变为蓝色
【解析】
(1)①中二氧化硫、亚铁离子均能被高锰酸钾氧化,且二氧化硫过量,不能说明反应产物中含亚铁离子,不合理;
②加入KSCN溶液,不变红,不存在铁离子,再加入新制的氯水,溶液变红,说明存在亚铁离子,方案合理;
③因亚硫酸钡能溶于酸,说明白色沉淀为硫酸钡,可说明二氧化硫被氧化为硫酸根离子,但是不能证明产物中有亚铁离子。上述实验方案中能证明该反应液有Fe2+生成的是②;
综上所述,本题选②。
(2)为证明氨气具有还原性,并检验生成物中有水生成;需先通过B中浓氨水反应制得氨气,除去氨气中的水,通入到用酒精灯加热的试管中,再验证生成物中含有水,最后吸收尾气,故连接顺序为BDADC;综上所述,本题答案是:B A C。
(3)浓氨水可以与碱、碱性氧化物反应生成氨气,故可以选择的试剂是①④,不可以选用酸性物质;综上所述,本题答案是:①④。
(4)氨气极易溶于水,且酸碱中和速度快,易产生倒吸现象;因此装置C中倒扣漏斗的作用是防止倒吸;综上所述,本题答案是:防止倒吸。
(5)由于在制氨气时需要除去水,氨气发生氧化还原反应又需要验证水,故D需要重复使用。除去水时,可以选择不与氨气反应的碱性干燥剂,如生石灰或碱石灰;验证水需要用无水硫酸铜,若有水通过,白色的无水硫酸铜变蓝色;综上所述,本题答案是:生石灰或碱石灰,无水硫酸铜。
(6)验证水需要用无水硫酸铜,若有水通过,白色的无水硫酸铜变蓝色;综上所述,本题答案是:白色粉末变为蓝色。


科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末
C.在空气中高温加热Fe(OH)3D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )

实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-===Cu2+,发生氧化反应
A. ①②③B. ②④C. ②③④D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知NO2和N2O4之间发生可逆反应:2NO2(g)(红棕色)![]() N2O4(g)(无色)
N2O4(g)(无色)
(1)在烧瓶A和B中盛有相同浓度的NO2与N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。

分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中____。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生_____。
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。
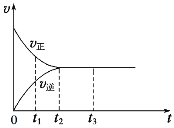
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
Ⅱ.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
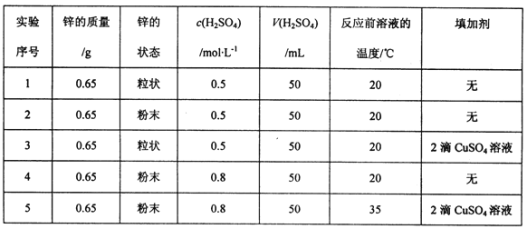
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。
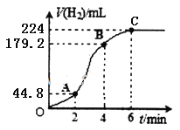
在OA、AB、BC三段中反应速率最快的是__,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石为原料制取Ti的反应为 : aTiO2+bCl2+cC![]() aTiCl4+cCO 反应(1)
aTiCl4+cCO 反应(1)
TiCl4+2Mg![]() Ti+2MgCl2 反应(2)
Ti+2MgCl2 反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应(1)、(2)中的还原性C>TiCl4,Mg>Ti;
④a=1,b=c=2;
⑤每生成19.2 g Ti(Ar=48),反应(1)、(2)中共转移4.8 mol e-。
A. 仅② B. ②③④ C. ③④ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“加碘食盐”“增铁酱油”“高钙牛奶”“富硒茶叶”“含氟牙膏”等名词,这里的碘、铁、钙、硒、氟应理解为( )
A.氧化物B.单质C.分子D.元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO42-、OH- B. Ca2+、Na+、NO3-、CO32-
C. Mg2+、Na+、Cl-、SO42- D. H+、Na+、HCO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com