
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答下列问题:
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是 (填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有 (填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题: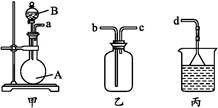
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为 。
②若在乙中收集氨气,气体流经装置的顺序是:a



 d(填接口代号)。
d(填接口代号)。
科目:高中化学 来源: 题型:填空题
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮可以去除油污,还可以____________________。
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是_____→洗涤→_____。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式 (K2Cr2O7被还原为Cr3+)。
(5)若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250mL,应准确称取K2Cr2O7 g(保留四位有效数字,已知M(K2Cr2O7)="294.0" g·mol-1)。配制该标准溶液时,下列仪器一定不要用到的有 (用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250 mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(6)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果_______(填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(4分)下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大 |
| B.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂。某化学兴趣小组进行如下实验。
【实验I】
用如下装置(已省略夹持装置)制NaNO2。
已知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。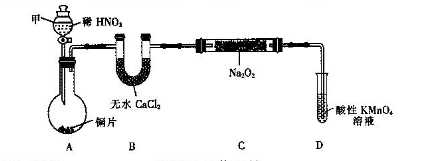
(1)仪器甲的名称是________.装置B的作用是_________________________。
(2)装置D可将剩余的NO氧化成NO ,发生反应的离子方程式为_____________。
,发生反应的离子方程式为_____________。
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低。为提高NaNO2纯度须对
上述实验装置或药品进行改进,其改进措施是________________________________。
【实验Ⅱ】
利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量。
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液 (M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0 mL并振荡,制成标准色阶。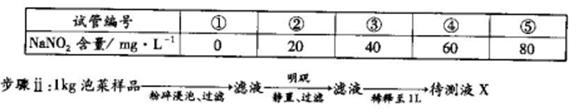
步骤ⅲ:取5 mL待测液X,加入1 mLM溶液,加蒸馏水至10mL振荡,与标准色阶比较。
(4)步骤ii获取待测液X的过程中,加入明矾的目的是__________。
(5)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为_________mg·kg-1
(6)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量。设计并完成下列实
验报告。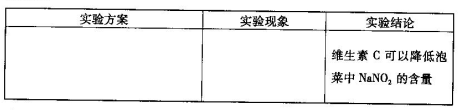
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定某铝镁合金中镁的质量分数,某小组计划将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。填写下列空白。
(1)同学们选用甲装置进行实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因是________________。
(2)同学们经讨论认为甲装置有两个方面会引起较大误差,分别是__________和__________。
(3)于是他们设计了实验装置乙。乙中导管a的作用是__________。若实验前后滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为______mL。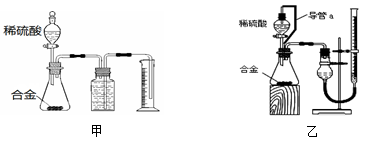
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2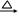 2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量)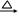 2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
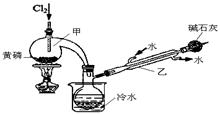
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学进行硫酸铜晶体结晶水含量的测定实验。完成下列填空:
【实验步骤】
(1)用_______(填仪器名称,下同)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入约2 g研细的硫酸铜晶体,并称量。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至____________中冷却到室温,并称量。
(4)重复(3)的实验进行恒重操作,直至两次称量结果相差不超过0.001 g。
【数据记录与处理】
| | 第一次实验 | 第二次实验 |
| 坩埚的质量(g) | 29.563 | 30.064 |
| 坩埚+试样的质量(g) | 31.676 | 32.051 |
| 恒重后,坩埚+硫酸铜的质量(g) | 30.911 | 31.324 |
| x的值 | 5.05 | 5.13 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
已知:几种化合物的溶解度(S)随温度(T)变化曲线如下图所示。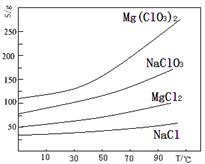
(1)过滤时主要玻璃仪器有 。加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是: 。
(3)“调节pH=4”可选用的试剂是 (填编号)
①MgO ②CuO ③稀NaOH溶液
④Mg ⑤稀硫酸 ⑥MgCO3
(4)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+。记录消耗K2Cr2O7溶液的体积。
①步骤2中发生反应的离子方程式为: 。
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则产品中Mg(ClO3)2·6H2O的含量会 。(填“偏高”、“偏低” 或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)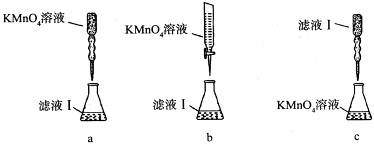
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。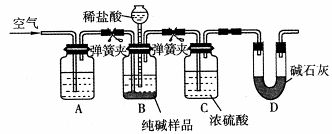
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com