
| A. | H2 | B. | CH4 | C. | HCl | D. | Cl2 |
科目:高中化学 来源: 题型:实验题
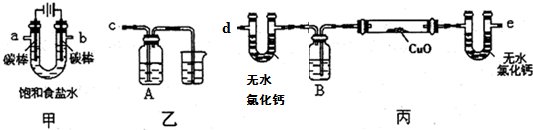
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的Na2O2为(x+y)mol | |
| B. | 反应后容器内有O2 (x+y) mol | |
| C. | 反应前后容器内压强之比为(温度不变):(x+y+z)/z | |
| D. | 反应后生成了x mol Na2CO3 和2y mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 28.6% | C. | 15% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
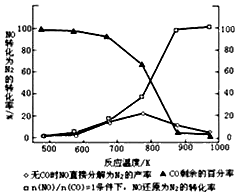 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L FeCl3溶液:K+、Br-、H2O2 | |
| B. | 含大量NO3-的溶液:Fe2+、SO42-、H+ | |
| C. | 水电离产生的c(OH-)=10-13mol/L的溶液:Al3+、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:NH4+、CrO42-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com