
【题目】反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,有关该反应的下列说法正确的是
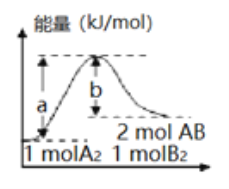
A. 每生成2 mol AB分子,需要吸收b kJ热量
B. 加入催化剂,(a-b)的差值减小
C. 该反应的反应物断键吸收的能量大于生成物成键放出的能量
D. 若反应生成AB为液态,每生成2 mol AB分子,需要吸收的热量大于(a-b) kJ
【答案】C
【解析】反应热=正反应活化能减去逆反应活化能;反应热=反应物断键吸收的能量减去生成物成键放出的能量;加入催化剂,改变反应历程,不能改变反应的反应热;气态物质变为液态要放出热量;据此分析解题。
根据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB吸收(a-b) kJ热量,A错误;催化剂只能够降低反应的活化能,不能改变反应的反应热,(a-b)的差值不变,B错误;该反应为吸热反应,因此该反应的反应物断键吸收的能量大于生成物成键放出的能量,C正确;根据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB(g)吸收(a-b) kJ热量,AB由气态变为液态,还要放出热量,因此若反应生成AB为液态,每生成2 mol AB分子,需要吸收的热量小于(a-b) kJ,D错误;正确选项C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
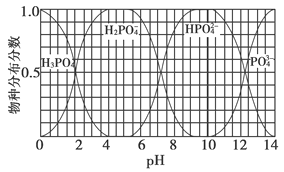
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷(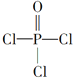 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
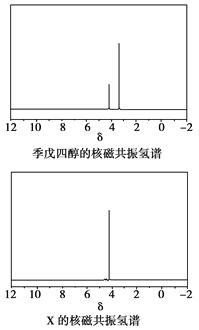
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
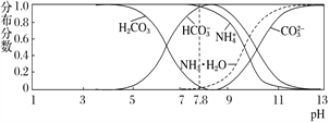
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )。
A. 氧化→吸收→吹出B. 氧化→吹出→吸收
C. 吹出→氧化→吸收D. 吹出→吸收→氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
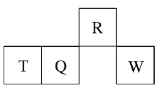
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 单质T与NaOH溶液不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
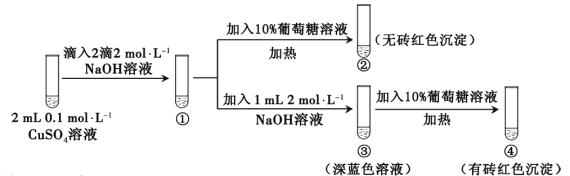
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收利用并获得能量,原理如图所示。下列说法正确的是( )
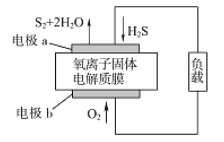
A. 电极b为电池负极
B. 电极a上的电极反应:2H2S+2O2--4e-=S2+2H2O
C. 电极b上的电极反应:O2+4e-+4H+=2H2O
D. 电路中每流过4mol电子,正极消耗44.8LH2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com