
【题目】纯碱的化学式为
A. NaCl B. NaOH C. Na2CO3 D. Na2SiO3
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.2mol/L草酸溶液中逐滴加入等浓度的NaOH溶液,溶液中各微粒的物质的量与混合溶液pH的关系如图所示,下列说法正确的是

A. 当V(NaOH溶液)<10mL时,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)
B. 当V(NaOH溶液)=10mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH溶液)=15mL时,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)
D. 当V(NaOH溶液)=20mL时,溶液中存在:c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。完成下列填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ |
(1)表中元素,原子半径最大的是_____(填写元素符号);原子核外有两个未成对电子的元素是_____________(填写编号);③和⑥两元素形成化合物的电子式为__________。
(2)⑥⑦两种元素最高价氧化物对应的水化物中,酸性最强的是__________(填化学式)。
(3)比③、④、⑤三种元素的简单离子半径: > > (填离子符号________;元素④最高价氧化物对应的水化物与硫酸反应的离子方程式为________________________。
(3)用一个化学方程式来证明元素②比元素⑥的非金属性强__________________________。
(4)③和⑥两元素形成的化合物溶于水,其溶液中离子浓度由大到小的顺序:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】罗马大学Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构如右图所示(与白磷P4相似)。已知断裂1 mol N—N键吸收167 kJ热量,生成 1 mol N≡N键放出 942 kJ 热量。由此判断下列说法正确的是( )

A. N4属于一种新型的化合物 B. N4与N2互为同分异构体
C. N4沸点比P4(白磷)高 D. 1 mol N4气体转变为N2将放出882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
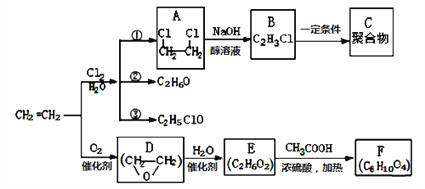
请完成下列问题:
(1)A的名称是___________,C的结构简式为_____________。
(2)E和CH3COOH反应生成F的化学方程式为____________,该反应的类型________。
(3)②和③是副反应,写出C2H5ClO的结构简式_________________________________。
(4)写出D的稳定同分异构体的结构简式____________。检验该同分异构体的实验步骤为_______________________________。
(5)高聚物C也可以用电石(CaC2)为主要原料来合成,写出其合成路线。____________________(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
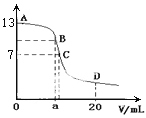
A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,商品名富血铁,含铁量高(33%),较难被氧化为三价铁,在胃内铁不直接游离,对胃黏膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂。实验采用反丁烯二酸(又称富马酸)为原料,在适当的pH条件下与Fe2+形成配合物。如图是合成富马酸铁的一种工艺路线:

回答下列问题:
(1)A的结构为_________(用结构简式或键线式表示),由A生成B的反应类型为__________
(2)C在NaOH乙醇溶液中反应的方程式为________
(3)富马酸的结构简式为__________
(4)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出_____ LCO2(标况下);富马酸的同分异构体中(包含顺反异构),同为二元羧酸的还有____(写出结构简式)。
(5)用石油裂解中得到的1,3-丁二烯合成丁烯二酸时,![]() 是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到
是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到![]() 的变化过程._____________
的变化过程._____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com