
A����֪2SO2(g)+O2 2SO3(g)Ϊ���ȷ�Ӧ����SO2������һ������SO3������ 2SO3(g)Ϊ���ȷ�Ӧ����SO2������һ������SO3������ |
| B����֪C(ʯī,s)=C�����ʯ,s����H��0������ʯ��ʯī�ȶ� |
| C����֪H+(aq)+OH-(aq)=H2O��1����H=��57��3kJ��mol�����κ�����к͵ķ�Ӧ�Ⱦ�Ϊ57��3kJ |
| D����֪2C(s)+2O2(g)=2CO2(g)��H1 |


 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
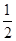 O2(g)=H2O(l) ��H1����285.8 kJ��mol��1 ��
O2(g)=H2O(l) ��H1����285.8 kJ��mol��1 ��| A�������ĸ���Ӧ�������ȷ�Ӧ |
| B��1 molҺ̬H2����������1 mol��̬H2������ |
| C��H2��ȼ����(��H)Ϊ��285.8 kJ��mol��1 |
D�������Һ��ȼ�յ��Ȼ�ѧ����ʽΪH2(l)��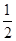 O2(l)=H2O(g) ��H����285.8 kJ��mol��1 O2(l)=H2O(g) ��H����285.8 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ϡ��Һ�У�H��(aq)����OH��(aq) = H2O(l)����H����57.3 kJ/mol��������0.6 mol H2SO4��ϡ�����뺬1 mol NaOH����Һ��ϣ��ų�����������57.3 kJ |
| B����֪C(ʯī��s)=C(���ʯ��s)����H��0������ʯ��ʯī�ȶ� |
| C����Ҫ���ȵķ�Ӧ˵���������ȷ�Ӧ |
| D����֪2C(s)��2O2(g)=2CO2(g)����H1��2C(s)��O2(g)=2CO(g)����H2����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����20.0g NaOH��ϡ��Һ��������ϡ������ȫ�кͣ��ų�28��7kJ�����������ʾ��[���ȵ��Ȼ�ѧ����ʽΪ2NaOH��aq����H2SO4��aq����Na2SO4��aq����2H2O��l����H����114��8kJ��mol |
B����֪�Ȼ�ѧ����ʽ��SO2��g���� O2��g�� O2��g�� SO3��g�� ��H����98��32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196��64kJ SO3��g�� ��H����98��32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196��64kJ |
| C����֪2H2��g����O2��g����2H2O��g���� ��H����483��6kJ��mol����H2��ȼ����Ϊ241��8kJ��mol |
| D����֪��S��s����O2��g����SO2��g���� ��H1��S��g��ʮO2��g����SO2��g������H2 ���H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ȼ����Ϊ��H=-890kJ��mol-1���� |
B��500�桢30MPa�£���0��5mol N2��1��5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19��3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g�� 2NH3��g����H=-38��6kJ?mol-1 2NH3��g����H=-38��6kJ?mol-1 |
| C����֪��H2��g)+F2(g) = 2HF(g)��H=" ��270" kJ/mol����1 mol������1 mol������Ӧ����2 molҺ̬������ų�������С��270 kJ |
| D����C����ͬ�����£�2 mol HF���������С��1 mol������1 mol�����������ܺ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
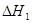 ="-443.64" kJ��mol-1
="-443.64" kJ��mol-1 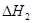 = -566.0kJ��mol-1
= -566.0kJ��mol-1 | A��CO��ȼ����Ϊ566.0 kJ��mol-1 |
| B��2 mol CO��1 mol O2����������2 mol CO2���������� |
| C����ȫȼ��20g�״������ɶ�����̼��ˮ����ʱ�ų�������Ϊ908.3 kJ |
D��2CH3OH��l��+3O2��g�� = 2CO2��g��+4H2O��g��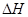 ="-1453.28" kJ��mol-1 ="-1453.28" kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������20NA������ת��ʱ���ų�2600kJ ���� |
| B������4NA��̼�����õ��Ӷ�����ʱ���ų�1300kJ���� |
| C��������NA��ˮ���������ʱ�Ϊ��H0�����H0<��H |
| D��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2��H3����ͬλ�� |
| B��O2+�в�����ѧ�� |
| C��C60�к��й��ۼ� |
| D��N5+�к������Ӽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com