
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )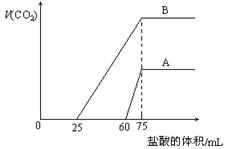
A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL
D
解析试题分析:观察图象,B曲线不产生气体需要盐酸的体积少于产生气体需要盐酸的体积,B曲线为Na2CO3和NaHCO3混合溶液,A曲线不产生气体需要盐酸的体积多于产生气体需要盐酸的体积,A曲线为Na2CO3和NaOH混合溶液。B错误。
B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为:H++CO32-=HCO3-,C错误;
无论A曲线或B曲线,当加入盐酸75mL时,产生二氧化碳气体体积最大,此时恰好完全反应,溶液中溶质为NaCl,Na+来自氢氧化钠,Cl-来自盐酸,n(Na+)=n(Cl-)=n(NaOH)=0.0075mol,所以每份溶液中c(NaOH)=0.75mol/L,A错误;
设B曲线溶液中Na2CO3物质的量为xmol,NaHCO3物质的量为ymol,
0→25发生反应:CO32-+H+=HCO3-
x x x
25→75发生反应:HCO3-+H+=H2O+CO2↑
x+y x+y
n(CO2)=x+y=0.005mol,V(CO2)=112mL,D正确。
考点:化学计算
点评:氢氧化钠溶液中通入二氧化碳气体,按二氧化碳由少到多,所得溶液中溶质可能为:(1)NaOH+Na2CO3;(2)Na2CO3;(3)Na2CO3+NaHCO3;(4)NaHCO3。


科目:高中化学 来源: 题型:阅读理解
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸盐化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. |  |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO2)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(SO2)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | ||
| 晶体类别 | 金属晶体 | |||
| 实例的化学式 | Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到224mL(标准状况)气体。
取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液,乙是 溶液;
(2)实验中所发生反应的离子方程式为: ;
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为 ;
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生气体体积为VmL(标准状况下),则V的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
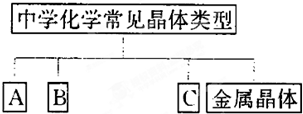
在理解概念的基础上,理清概念之间的相互关系,构建知识网络是学习化学的重要方法,下图是中学化学常见化学概念之间的相互关系。
 |
(1) 完成下表,且实例按以下要求填写。
①只能由H、O、N、Si、S元素中的一种或几种组成物质;②每种元素只能出现一次,化合物中最多含一种原子团;③所填物质必须能够回答问题(2)和问题(3)。
A | B | C | ||
晶体类别 | 金属晶体 | |||
实例的化学式 | Na |
(2)取上述表格中A、B、C三种晶体中某一晶体溶于水得W溶液,写出等物质的量浓度等体积的硫酸氢钠与W溶液反应的离子方程式 ;
(3)写出上述表格中熔点最高的具体物质与氢氧化钠反应的化学方程式 。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com