
【题目】净水剂铁酸钠(Na2FeO4)中,铁元素的化合价是
A. +6B. +5C. +3D. +2
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是
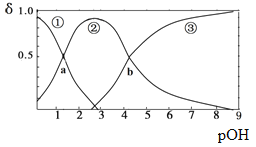
A. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、Na2SO4、Na2CO3、泥沙(SiO2)等杂质的NaNO3固体,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
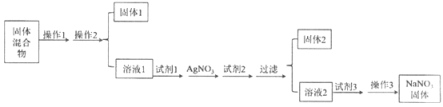
(1)操作1、操作3的名称分别是_________、_________。
(2)试剂1和试剂2分别是_________、_________。固体2中除了含有AgCl,还有_________(答全)。
(3)试剂3加入后发生的离子反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0mL于锥形瓶中,加入10.0mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KC1+I2,滴入指示剂2~3滴。
②取碱式滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol/LNa2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问题:
(1)步骤①加入的指示剂是____________。
(2)判断达到滴定终点的实验现象是____________。
(3)假设未描述的事项都规范合理,则该测定结果将_______(填“偏高”、“偏低”或“无影响”)。
(4)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9X10-2,K2=6.4×10-5。0.1mol/LNa2CO3溶液的pH____0.1mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是________。(选填编号)
A. c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) B. c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C. c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D. c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(5) 已知: ①难溶电解质的溶度积常数: Ksp(CaF2)=1.5×10-10②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH (忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示,请根据以下信息回答下列问题:

①25℃时,HF电离平衡常数的数值Ka≈________。
②4.0×10-3mo1/LHF溶液与4.0×10-4mo1/L CaCl2液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),请通过列式计算说明是否有沉淀产生:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类中依次按照强电解质、弱电解质和非电解质排列全部正确的组合是()
A.NaCl HF Cl2B.NaHCO3 NH3·H2O CCl4
C.Ba(OH)2 HCl CuD.AgCl H2SO4 C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、实验现象和所得结论均正确的是
实验操作 | 实验现象 | 结论 | |
A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
B | 用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
C | 向浓度均为0.1 mol·L-1NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
D | 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 | 产生白色沉淀,红色褪去 | 证明CO32-水解呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1)A的名称是_________;C的官能团的名称是_________。
(2)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_________ .
(3)E分子中含有两个酯基,且为顺式结构,E的结构简式为_________ .
(4)反应①的化学方程式为_________ 。
(5)试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6)已知:  。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成
。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成![]() 。将以下合成路线补充完整:_________________
。将以下合成路线补充完整:_________________

(7)已知氨基(-NH2)与羟基类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是

A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
A. v(O2)=0.01mol/(L·s) B. v(NO)=0.08mol/(L·s)
C. v(H2O)=0.003mol/(L·s) D. v(NH3)=0.001mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com