


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是 。
?A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
?(2)电解 NaCl溶液是氯碱工业的核心反应,请写出其化学方程式
。
??(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
? (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
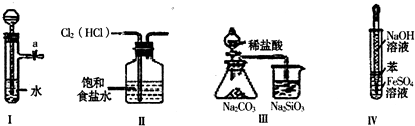
? (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
?
①整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
? ②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
? ③C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是 。
?A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
?(2)电解 NaCl溶液是氯碱工业的核心反应,请写出其化学方程式
。
??(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
? (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
? (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
?
①整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
? ②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
? ③C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三上学期第一次诊断性测试化学卷 题型:综合题
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是 。
?A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
?(2)电解 NaCl溶液是氯碱工业的核心反应,请写出其化学方程式
。
??(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
? (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
? (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
?
①整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
? ②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
? ③C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是 。
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
(2)电解 NaCl溶液是氯碱工业的核心反应,请写出其化学方程式
。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
①整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
③C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是 。
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
(2)电解 NaCl溶液是氯碱工业的核心反应,请写出其化学方程式
。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
①整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
③C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com