
| A. | O2 | B. | N2 | C. | H2S | D. | CO2 |
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
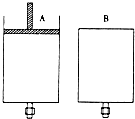 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质依据是具有丁达尔效应 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体粒子也一定会向某一极移动 | |
| C. | 纳米材料粒子直径一般在10-9m与10-7m之间,因此纳米材料属于胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol 电子,锌的质量理论上减少6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和一个-Cl,它的可能结构有四种,请写出这四种可能的结构简式:
和一个-Cl,它的可能结构有四种,请写出这四种可能的结构简式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -285.8kJ/mol | B. | 285.8kJ/mol | C. | -241.8 kJ/mol | D. | 241.8kJ/md |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com