
完全中和5.1 g二元酸H2A生成正盐,用去12 g NaOH,则关于二元酸的说法正确的是( )。
A.该酸的摩尔质量是17g·mol-1
B.该酸中A的相对原子质量是34 g·mol-1
C.10.2 g该酸的物质的量是0.3 mol
D.该酸一定是强酸
科目:高中化学 来源: 题型:
绿原酸的结构简式如图所示下列有关绿原酸的说法不正确的是
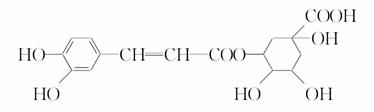
A.分子式为C16H18O9
B.0.1 mol绿原酸最多与0.8 mol NaOH反应
C.能与Na2CO3反应
D.能发生取代反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是 ( )
A.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
B.Ba(NO3)2 溶于水,可将含Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C. 不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硫酸溶液中和
D. 酒精灯不慎着火,应立即用水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
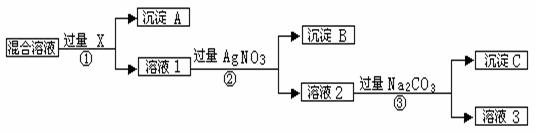
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X : ,沉淀A: ,沉淀B: 。
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 _________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组在实验室中探究Ti、Mg、Cu的活动性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象如下:
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡 速率缓慢 | 放出气泡 速率快 | 无变化 |
下列有关三种金属的说法正确的是( )。
A.三种金属的活动性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30 mL,加入同一种镁铝合金粉末,产生气体,有关数据列表如下(气体体积在标准状况下测定):
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸________(填“过量”“适量”或“不足量”),理由是________________。
(2)要计算盐酸的物质的量浓度,题中可作计算依据的数据是________。
(3)要计算合金中Mg、Al的物质的量之比,题中可作计算依据的数据是________,Mg、Al的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 从海水中可以提取溴,主要反应为2Br-+Cl2==2Cl-+Br2,下列说法正确的是( )。
从海水中可以提取溴,主要反应为2Br-+Cl2==2Cl-+Br2,下列说法正确的是( )。
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
在A2+3B2 = 2C的反应中,经过t秒钟后,C的浓度增加了0.6mol/L,在此期间,反应速率V(B2)=0.45mol/(L·S),则t值为
A. 1秒 B. 1.5秒 C. 2秒 D. 2.5秒
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应: 2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为:
(填“吸热”或“放热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com