
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |



科目:高中化学 来源:不详 题型:填空题
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用SO2漂白纸浆和草帽辫 |
| B.用氯化铁溶液腐蚀印刷线路板上的铜膜 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.高温下用焦炭还原SiO2制取粗硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
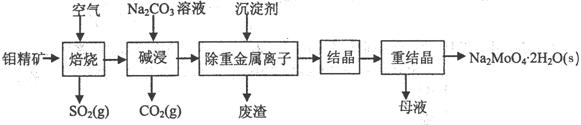 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
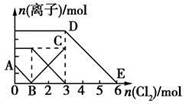
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +O2+xOH-===Fe3O4+S4O
+O2+xOH-===Fe3O4+S4O +2H2O,下列说法中,正确的是( )
+2H2O,下列说法中,正确的是( )| A.每生成1mol Fe3O4,反应转移的电子总数为3mol |
B.Fe2+和S2O 都是还原剂 都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.x=2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com