
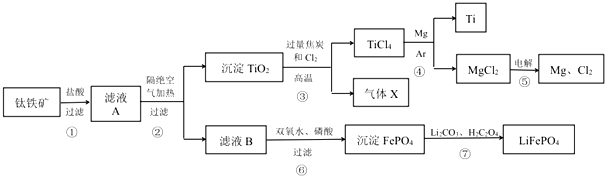
分析 钛铁矿(主要成分为 FeTiO3,可表示为 FeO•TiO2)加入盐酸溶解过滤得到滤液A为FeCl2、TiOCl42-,加热促进水解,过滤得到沉淀TiO2,滤液 B为FeCl2溶液,TiO2和C、Cl2在高温条件下生成TiCl4和CO,所以X为CO,TiCl4在稀有气体的环境中高温条件下被镁还原生成Ti和MgCl2,电解生成镁和氯气,氯气可以在步骤③中循环利用,镁可以在步骤④中循环利用,FeCl2溶液中加入双氧水氧化亚铁离子,与磷酸反应生成磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4,据此答题.
解答 解:钛铁矿(主要成分为 FeTiO3,可表示为 FeO•TiO2)加入盐酸溶解过滤得到滤液A为FeCl2、TiOCl42-,加热促进水解,过滤得到沉淀TiO2,滤液 B为FeCl2溶液,TiO2和C、Cl2在高温条件下生成TiCl4和CO,所以X为CO,TiCl4在稀有气体的环境中高温条件下被镁还原生成Ti和MgCl2,电解生成镁和氯气,氯气可以在步骤③中循环利用,镁可以在步骤④中循环利用,FeCl2溶液中加入双氧水氧化亚铁离子,与磷酸反应生成磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4,
(1)根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O可知,反应中没有元素的化合价的变化,所以该反应属于非氧化还原反应,
故答案为:非氧化还原反应;
(2)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H++4Cl-;
(3)根据上面的分析可知,X主要成分是CO,
故答案为:CO;
(4)根据①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ•mol-1,②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ•mol-1,利用盖斯定律可知,将①×2-②可得Mg(s)与 TiCl4(s)反应生成 Ti(s)和MgCl2(s)的反应,所以该反应的反应热为△H=-641kJ•mol-1×2-(-770kJ•mol-1)=-512 kJ•mol-1,热化学方程式是2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=-512 kJ•mol-1;因为镁能与氮气反应生成氮化镁,所以不能将第④步中的Ar换成N2,
故答案为:2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=-512 kJ•mol-1;不能,镁会与氮气发生反应;
(5)根据上面分析可知,上述流程中可循环使用的物质是Mg、Cl2,
故答案为:Mg、Cl2;
(6)根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
H2O2 ~H2C2O4,
34 90
x×17% y
34y=90×x×17%,x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,
故答案为:20:9.
点评 本题借助利用钛铁矿制备锂离子电池电极材料流程,考查了化合价判断、离子方程式书写等知识,本题难度中等,涉及的内容较多,综合性较强,充分考查了学生的综合能力,注意结合流程书写反应式.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
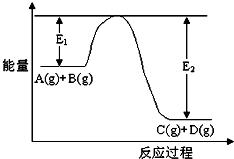 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
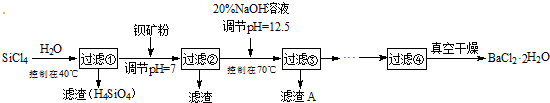
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b<a<0 | B. | b>a>0 | C. | a=b<0 | D. | a=b>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com