
����Ŀ����ҵ�������̿�MnCO3���ۺ�FeCO3��SiO2��Cu2(OH)2CO3�����ʣ�Ϊԭ����ȡ�������̣�������ʾ��ͼ���£�
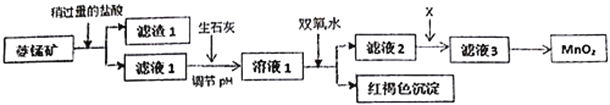
��֪�������������������pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
Ksp(CuS)=6.3��10-16 Ksp(MnS)= 3��10-14
ע���������ӵ���ʼŨ��Ϊ0.1 mol/L
�ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ����_________________________������1�ijɷ���_________�������ܽ�MnCO3�����ӷ���ʽ��_________________________________��
��2������ʯ�Ҷ�����NaOH����pH��ԭ����_______________________________��
��3����Һ2�м���ij������X���Գ�ȥCu2+�����ʺϵ���_______________��
A.MnO2 B.NaOH C.MnS
�÷�Ӧ�����ӷ���ʽ��____________________________��
��4����MnCl2ת��ΪMnO2��һ�ַ����ǽ��ữ��NaClO3��Һ����Mn2+���벹�䲢��ƽ���з��̣�____Mn2++_____ClO3-+______��____Cl2��+____MnO2+_________��_________________
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ�����������������������������������
�� MnO2�ڵ��ص�__________________������������������������������������ɣ�
�� ��ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2������Cl2�IJ�����_______________��
���𰸡� ����Ӧ��Ӵ��������߷�Ӧ���� SiO2 MnCO3+2H+=Mn2++CO2��+H2O ��ʯ�Ҿ���ʵ�� C MnS+Cu2+��Mn2++CuS 5 2 4H2O 1 5 8H+ ���� ����ʪ�ĵ��۵⻯����ֽ������������������ֽ������֤����Cl2����
��������������Ҫ���������ȡ�������̹������̵����ۡ�
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ��������Ӧ��Ӵ��������߷�Ӧ���ʡ�����1�ijɷ��Dz����������SiO2�������ܽ�MnCO3�����ӷ���ʽ��MnCO3+2H+=Mn2++CO2��+H2O��
��2������ʯ�Ҷ�����NaOH����pH��ԭ������ʯ�Ҿ���ʵ����
��3����Һ2�м���ij������X���Գ�ȥCu2+�����ʺϵ���C����A.��Ч��B.������������Na+��C.���ʣ���ѡC���÷�Ӧ�����ӷ���ʽ��MnS+Cu2+��Mn2++CuS��
��4�����ݵ����غ����������ʽ��ƽΪ5Mn2++2ClO3-+______��Cl2��+5MnO2+_________�� �ٸ��ݵ���غ��Ԫ���غ����������ʽ��5Mn2++2ClO3-+4H2O ��Cl2��+5MnO2+8H+��
��5����MnO2����������ڵ��ص��������ɣ�
������Cl2�IJ����ǽ���ʪ�ĵ��۵⻯����ֽ������������������ֽ������֤����Cl2���ɡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Һ��������������ռ���Һ��װ����ͼ��ʾ������������������Ϊ���Ե缫�����ͬ��ͬѹ�£�������������ҵ������ԼΪ1��2������˵������ȷ���ǣ������� 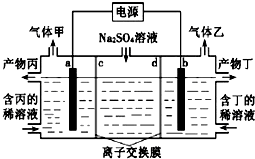
A.a�����Դ����������
B.�����Ϊ������Һ
C.���ӽ���ĤdΪ�����ӽ���Ĥ������������ͨ����
D.a�缫��ӦʽΪ2H2O+2e���T2OH��+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al��SO4��2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У�NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺ 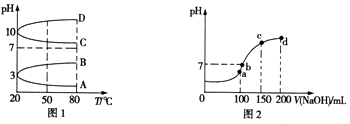
��1����ͬ�����£����Ũ�ȵ�NH4Al��SO4��2��Һ��c��NH4+��NH4HSO4��Һ��c��NH4+�� ���=������������������
��2����ͼ1��0.1molL��1�������Һ��pH���¶ȱ仯��ͼ�� �����з���0.1molL��1 NH4Al��SO4��2��pH���¶ȱ仯������������д��ĸ����
������ʱ��0.1molL��1 NH4Al��SO4��2��Һ��2c��SO42������c��NH4+����3c��Al3+��=molL��1����
����ʽ����
��3������ʱ����100mL 0.1molL��1 NH4HSO4��Һ�еμ�0.1molL��1NaOH��Һ���õ���Һ��pH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ��ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�����������b�㣬��Һ�и�����Ũ���ɴ�С��˳���� ��
��4������Ʊ�Al��OH��3ʱ���缫�ֱ�ΪAlƬ��ʯī���������ҺΪNa2CO3��Һ������ܷ�Ӧ�ķ���ʽΪ ��
��5��һ�ֿɳ��������������أ���ŵ�ʱAlCl4����Al2Cl7������������Al�缫���ת�����������Ӳ�����缫��Ӧ���ŵ�ʱ����Al�ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС������ͼ1װ�ã��г�װ���ԣ��ռ�ij���Ѿ���SO2 �� ���Ժ������вⶨ�� 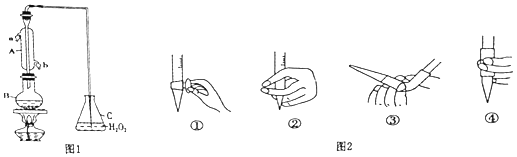
��1������A�������� ��
��2��B�м���300.00mL���Ѿƺ��������ᣬ����ʹSO2ȫ���ݳ�����C��H2O2��ȫ��Ӧ���仯ѧ����ʽΪ ��
��3����ȥC�й�����H2O2 �� Ȼ����0.0900mol/LNaOH����Һ���еζ����ζ�ǰ������ʱ��Ӧѡ��ͼ2�е� ��
��4�����ζ��յ�ʱ��Һ��pH=8.8����ѡ���ָʾ��Ϊ ��
��5���òⶨ���������ʵ��ֵƫ�ߣ����������ڲ����Լ���������ģ����ܵ�ԭ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.C60����ʯһ������ԭ�Ӿ���
B.�ɷǽ���Ԫ����ɵĻ����ﲻһ���ǹ��ۻ�����
C.���Ӿ����бغ���ѧ��
D.�ɱ������ƻ��˹��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ��Ϊԭ�Ϻϳɼ״����й��Ȼ�ѧ����ʽ���£�
��2CH4(g)+O2(g)==2CO(g)+4H2(g) ��H1=-70.8kJmol-1
��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
��2CH4(g)+O2(g)![]() 2CH3OH(g) ��H3=-251.0 kJmol-1
2CH3OH(g) ��H3=-251.0 kJmol-1
��1����Ӧ������H2=________kJmol-1��
��2��������ɱ���ܱ�������Ͷ��1 mol CO��2 mol H2���ڲ�ͬ�����·�����Ӧ��CO(g)+2H2(g)![]() CH3OH(g)��ʵ����ƽ��ʱCH3OH�����ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��
CH3OH(g)��ʵ����ƽ��ʱCH3OH�����ʵ������¶ȡ�ѹǿ�仯��ͼ1��ʾ��

��M ��ʱ��H2 ��ת����Ϊ_________��ѹǿ�� p1_______���>����<����=����p2��
����Ӧ������N ��v��(CO) _______���>����<����=����M ��v ��(CO)
����ѹǿΪp1����1L�����ܱ������н���������Ӧ����ʼͶ�ϲ��䣩���ڲ�ͬ�¶���������Ӧ��ƽ�ⳣ���Ķ���(IgK)��ͼ2��ʾ�����¶�Ϊ506Kʱ��ƽ�ⳣ��K=____________�� B��C��D��E�ĵ�������ȷ��ʾ�÷�Ӧ��1gK ��T�Ĺ�ϵ�ĵ�Ϊ________________��
������2L�����ܱ������г���x (x>0)mol H2��2 mol CO����8 mol CH3OH(g)���� 506 K�½���������Ӧ��Ϊ��ʹ�÷�Ӧ������У�x�ķ�ΧΪ________________��
��3��ij�״�-����ȼ�ϵ����KOH��ҺΪ�������Һ����KOHȫ��ת����KHCO3ʱֹͣ�ŵ���д����ʱ�����ĵ缫��Ӧʽ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.����Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ء� ��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز���������

�Իش��������⣺
(1)ȼ�ϵ�ص��ŵ���________���������Һ�е�OH-����______��(�����������)��
(2)д������ȼ�ϵ�ع���ʱ������Ӧʽ��_______________________��
(3)������ȼ�ϵ�ظĽ�Ϊֱ���Լ��������Ϊԭ�Ͻ��й���ʱ��������ӦʽΪ___________��
(4)���ø�װ�ÿ��Դ��������������NH3 β��,�ܷ�ӦΪ��6NO2 +8NH3=7N2+12H2O��������ӦʽΪ__________��
II.��пƬ����Ƭ����ϡ���������ԭ��أ����õ�������缫��������Ϊ80 g������һ��ʱ���ȡ��пƬ����Ƭϴ���������أ�������Ϊ41g���Լ��㣺
��1���������������(��״��)Ϊ________________��
��2��ͨ�����ߵĵ�����Ϊ__________����NA��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�Ǽ��ֳ����Ļ�ѧ��Դʾ��ͼ���й�˵������ȷ���ǣ������� 
A.������طֱ�����һ�ε�ء����ε�غ�ȼ�ϵ��
B.�ɵ���ڳ�ʱ��ʹ�ú�пͲ���ƻ�
C.����ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ
D.Ǧ���ع��������У�ÿͨ�� 2 mol ���ӣ������������� 207 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����ָ������������½���ѧ��ת��Ϊ���ܵ�װ�á�ij����ȼ�ϵ�صĹ���ԭ����ͼ��ʾ������˵����ȷ����

A. HS-����������������ת��ΪSO42-�ķ�ӦΪ:HS-+4H2O-8e-== SO42-+9H+
B. ���Ӵ�b�����������·����a
C. �������Ӧ��ֱ��ȼ��,�����������ʲ���仯
D. ���õ�ص�·����0.4mol���ӷ���ת�ƣ�����0.5molH+ͨ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com