

| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
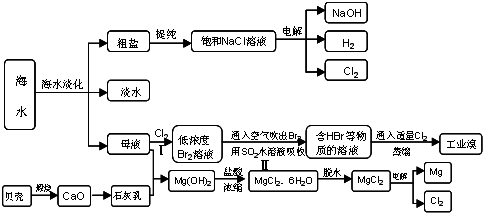
科目:高中化学 来源: 题型:
(10分)
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
(1)请列举海水淡化的两种方法 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br—,其目的是: 。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2•6H2O,其原因用化学方程式表示为
(4)上述工艺中可以得到金属Mg,请写出工业上冶炼金属铝的化学方程式
。
查看答案和解析>>
科目:高中化学 来源:2012届湖北省高二上学期期末考试化学试卷 题型:填空题
(7分)海水是人类宝贵的自然资源,从海水中可以提取多种化工原料。下图是某工厂对海水资源综合利用的示意图。
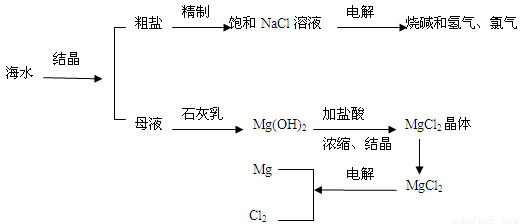
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液。精制时通常向精盐溶液中依次加入过量的BaCl2溶液,过量的NaOH溶液和过量的Na2CO3溶液,过滤出沉淀后再向滤液加入盐酸至溶液呈中性。请写出下列操作中有关化学反应的离子方程式:
①向溶液中加入过量的Na2CO3溶液:__________________、_____________________;
②电解氯化钠溶液:______________________________________________。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可以看出,对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是:(用离子反应方程式回答)___________________________。
②简述怎样操作才能由氯化镁晶体得到无水氯化镁:____________________________。
查看答案和解析>>
科目:高中化学 来源:2012届济南市高二第二学期期末考试化学试卷(理科) 题型:填空题
(10分)
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
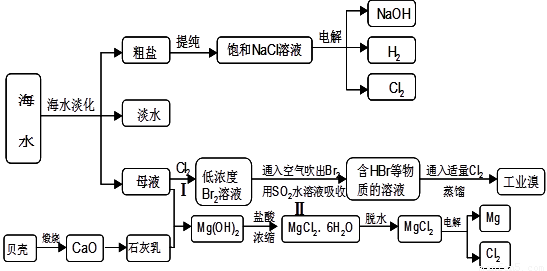
(1)请列举海水淡化的两种方法 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br—,其目的是: 。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2•6H2O,其原因用化学方程式表示为
(4)上述工艺中可以得到金属Mg,请写出工业上冶炼金属铝的化学方程式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com