
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示.

(1)A→C的反应类型是___________;A~D中互为同分异构体的是___________(填代号).
(2)由A生成B的化学方程式是:_____________________________________________.
(3)C在一定条件下发生加聚反应的化学方程式是:______________________________.
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
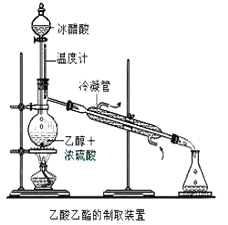
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是形成酸雨的成因之一,与其他污染物在一定条件下能产生光化学烟雾,加大对氮氧化物的处理是环境治理的重要研究内容。
(1)NH3催化NOx是目前应用最广泛的烟气氮氧化物脱除技术。
已知.①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g)![]() N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2N0(g)![]() N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容积恒定为1L的密闭容器中反应,经过10min反应达到平衡,测得NO的物质的量为0.5mol。
N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容积恒定为1L的密闭容器中反应,经过10min反应达到平衡,测得NO的物质的量为0.5mol。
①10min内,平均反应速率v(N2)=______,在T℃时,该反应的平衡常数K=_______。
②能判断该反应一定达到化学平衡状态的依据是______(填标号)。
a.单位时间内生成2nmolNO的同时消耗nmolCO2
b.反应体系的温度不再发生改变
c.恒容条件下,混合气体的密度不再发生改变
d.恒温恒容条件下,反应体系的压强不再发生改变
(3)电化学住化净化NO是一种新颖的处理氮氧化物的方法。原理如下图,固体电解质起到传导O2-的作用,则通入NO的电极反应式为________。

(4)已知:25℃时,HNO2的电离常数Ka=7.1×10-4,CH3COOH的电离常数K=1.8×10-5,实验室时可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。②③
①已知溶液甲为浓度均为0.1mol· L-1,的NaNO3和NaNO2的混合溶液,溶液乙为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_______,能使溶液甲和溶液乙的pH相等的方法是_______(填标号)。
a.向溶液甲中加适量水 b. 向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d. 向溶液乙中加适量NaOH
②25℃时,向0.1mol·L-1CH3COOH溶液中加入一定量的CH3COONa溶液,使溶液中c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关银镜反应的说法中,正确的是( )
A. 配置银氨溶液时氨水必须过量
B. 1 mol甲醛发生银镜反应最多生成2 molAg
C. 银镜反应通常采用水浴加热
D. 铸银镜反应后的试管一般采用浓硝酸洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,以它为原料还可以合成很多的化工产品。现有以下转化:

(1)聚乙烯的结构简式为 ;
(2)写出以下反应的化学方程式和反应类型:
② ,反应类型是
③ ,反应类型是
(3)实验室用如图装置制备乙酸乙酯:试管中碎瓷片的作用是 ;导管a的作用是导气和 ;试管b内饱和Na2CO3溶液的作用一方面是除去乙酸乙酯中混有的乙酸和乙醇,另一方面是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:

已知:
请回答:
(1)化合物A的质谱图如下图所示,则A的化学名称为________。

(2)高分子化合物D的单体是_______;M中含氧官能团的名称为____________。
(3)F→G的化学反应类型为__________;检验产物G中新生成官能团的实验方法为___________________。
(4)C→D的化学方程式为___________________________。
(5)E的结构简式为________;H的顺式结构简式为___________。
(6)同时满足下列条件的F的同分异构体有________种(不考虑立体异构);
①属于芳香族化合物②能发生水解反应和银镜反应。其中核磁共振氢谱有4种吸收峰的物质的结构简式为_________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:

已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)Y元素在周期表中的位置是______;X、Y原子半径的大小:X______Y(填“>”、“<”或“=”)
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入______(填物质名称);负极电极反应式为______。
(3)C在一定条件下反应生成A的化学方程式是___________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是______(填写下列各项的序号)。
a.达到化学平衡的过程中,混合气体平均相对分子质量减小
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d. 达到化学平衡时,正反应速率与逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶质都为1mol的NH4HCO3稀溶液和Ba(OH)2稀溶液混合,能完整表示该反应离子方程式的是
A. CO32-+Ba2+→BaCO3↓
B. HCO3-+OH-→H2O+CO32-
C. Ba2++2OH-+NH4++HCO3-→BaCO3↓+NH3H2O+H2O
D. Ba2++OH-+NH4++HCO3-→BaCO3↓+NH3H2O+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com