
ГєбѕПЩгУгкОЛЛЏПеЦјЁЂвћгУЫЎЕФЯћЖОЁЂДІРэЙЄвЕЗЯЮяКЭзїбѕЛЏМС.
ЃЈ1ЃЉГєбѕМИКѕПЩгыçЁЂН№ЁЂвПЁЂЗњвдЭтЕФЫљгаЕЅжЪЗДгІЁЃШч:6Ag(s)+O3(g)=3Ag2O(s)? ІЄH=-235.8kJ/mol.вбжЊ2Ag2O(s)=4Ag(s)+O2(g)? ІЄH=+62.2kJ/mol,дђГЃЮТЯТЗДгІ: 2O3(g)=3O2(g)ЕФІЄH=?????????????????????? .
ЃЈ2ЃЉПЦбЇМвP.TatapudiЕШШЫЪзЯШЪЙгУдкЫсадЬѕМўЯТЕчНтЫЎЕФЗНЗЈжЦЕУГєбѕЁЃГєбѕдкбєМЋжмЮЇЕФЫЎжаВњЩњ,ЕчМЋЗДгІЪНЮЊ3H2O-6e-=O3Ёќ+6H+,вѕМЋИННќШмНтдкЫЎжаЕФбѕЦјЩњГЩЙ§бѕЛЏЧт,ЦфЕчМЋЗДгІЪНЮЊ???????????????????? ЁЃ
ЃЈ3ЃЉO3дкМюадЬѕМўЯТПЩНЋNa2SO4бѕЛЏГЩNa2S2O8ЁЃаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК????????????????????????
 ???????????
??????????? 
ЃЈ4ЃЉЫљЕУЕФNa2S2O8ШмвКПЩНЕНтгаЛњЮлШОЮя4-CPЁЃдвђЪЧNa2S2O8ШмвКдквЛЖЈЬѕМўЯТПЩВњЩњЧПбѕЛЏадздгЩЛљЃЈSO4-ЁЄЃЉЁЃЭЈЙ§ВтЖЈ4-CPНЕНтТЪПЩХаЖЯNa2S2O8ШмвКВњЩњSO4-ЁЄЕФСПЁЃФГбаОПаЁзщЩшМЦЪЕбщЬНОПСЫШмвКЫсМюадЁЂFe2+ЕФХЈЖШЖдВњЩњSO4-ЁЄЕФгАЯьЁЃ
ЂйШмвКЫсМюадЕФгАЯьЃКЦфЫћЬѕМўЯрЭЌЃЌНЋ4-CPМгШыЕНВЛЭЌpHЕФNa2S2O8ШмвКжаЃЌНсЙћШчЭМaЫљЪОЁЃгЩДЫПЩжЊЃКШмвКЫсаддіЧПЃЌ???????????????? ЃЈЬю ЁАгаРћгкЁБЛђЁАВЛРћгкЁБЃЉNa2S2O8ВњЩњSO4-ЁЄЁЃ
ЂкFe2+ХЈЖШЕФгАЯьЃКЯрЭЌЬѕМўЯТЃЌНЋВЛЭЌХЈЖШЕФFeSO4ШмвКЗжБ№МгШыc(4-CP)=1.56ЁС10-4 molЁЄLЃ1ЁЂc(Na2S2O8)=3.12ЁС10-3 molЁЄLЃ1ЕФЛьКЯШмвКжаЁЃЗДгІ240 minКѓВтЕУЪЕбщНсЙћШчЭМbЫљЪОЁЃвбжЊ S2O82- + Fe2+= SO4-ЁЄ+ SO42- + Fe3+ЁЃдђгЩЭМЪОПЩжЊЯТСаЫЕЗЈе§ШЗЕФЪЧЃК_________________ЃЈЬюађКХЃЉ
A.ЗДгІПЊЪМвЛЖЮЪБМфФкЃЌ 4-CPНЕНтТЪЫцFe2+ХЈЖШЕФдіДѓЖјдіДѓЃЌЦфдвђЪЧFe2+ФмЪЙNa2S2O8ВњЩњИќЖрЕФSO4-ЁЄЁЃ
B.Fe2+ЪЧ4-CPНЕНтЗДгІЕФДпЛЏМС
C.ЕБc(Fe2+)Й§ДѓЪБЃЌ4-CPНЕНтТЪЗДЖјЯТНЕЃЌдвђПЩФмЪЧFe2+ЛсгыSO4ЁЊЃЎЗЂЩњЗДгІЃЌЯћКФВПЗжSO4ЁЊЃЎЁЃ
D.4-CPНЕНтТЪЗДЖјЯТНЕЃЌдвђПЩФмЪЧЩњГЩЕФFe3+ЫЎНтЪЙШмвКЕФЫсаддіЧПЃЌВЛРћгкНЕНтЗДгІЕФНјааЁЃ
ЂлЕБc(Fe2+)ЃН3.2 ЁС10-3 molЁЄLЃ1ЪБЃЌ4-CPНЕНтЕФЦНОљЗДгІЫйТЪЕФМЦЫуБэДяЪНЮЊ??????????????? ЁЃ
ЃЈ1ЃЉ-285.0KJ.mol-1 ЃЈ3ЗжЃЉ
ЃЈ2ЃЉ3O2 + 6H+ +6e- = 3H2O2 ЃЈЛђO2 +2H+ +2e- = H2O2ЃЉ ЃЈ3ЗжЃЉ
ЃЈ3ЃЉ2Na2SO4 + O3 + H2O = Na2S2O8 + 2NaOH + O2? ЃЈ3ЗжЃЉ
ЃЈ4ЃЉ ЂйгаРћгк?? ЃЈ2ЗжЃЉ
ЂкACЃЈ2ЗжЃЉ
Ђл
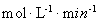 ? ЃЈ3ЗжЃЉ
? ЃЈ3ЗжЃЉ
ЁОНтЮіЁП
ЪдЬтЗжЮі:ЃЈ1ЃЉИљОнИЧЫЙЖЈТЩЃЌЫљЧѓЗНГЬЪНПЩгЩ3ЁСЂк-1ЁСЂйЖјЕУЃЌЫљвдІЄH=3ЁС(+62.2kJ/mol) -2ЁС(-235.8kJ/mol)= -285.0KJ.mol-1 ЁЃ
ЃЈ2ЃЉгЩгкЕчНтЫЎЗЈжЦГєбѕЪЕжЪЪЧЕчНтШмНтгабѕЦјЕФЫЎШмвК3O2 + 3H2O = O3Ёќ+3H2O2 ЃЌЫфШЛЫсадЬѕМўЯТЃЌЕЋЫуВЛВЮМгЗДгІЃЌЫљвдЕчНтЙ§ГЬжабєМЋЗЂЩњЕФбѕЛЏЗДгІЮЊH2OЪЇЕчзгБфГЩГєбѕЃЌЖјВЛФмЪЧOH-ЃЌвѕМЋЗЂЩњЕФЛЙдЗДгІЮЊO2ЕУЕчзгБфГЩH2O2ЃЌЫљвдвѕМЋЕчМЋЗДгІЪНЮЊЃКO2 +2H+ +2e- = H2O2 ЃЌШєвЊвѕбєМЋЕУЪЇЕчзгЭГвЛЃЌвВПЩаДГЩ3O2 + 6H+ +6e- = 3H2O2 ЁЃ
ЃЈ3ЃЉO3дкМюадЬѕМўЯТНЋNa2SO4бѕЛЏГЩNa2S2O8ЕФЗДгІЪЧвЛИібѕЛЏЛЙдЗДгІЃЌвЊзЂвтЕФЪЧO3ЕФаджЪКЭO2ЯрБШЃЌГєбѕгаНЯЧПЕФбѕЛЏадЃЌЖјЧвВЛЮШЖЈЃЌШнвзБфГЩЮЊO2ЃЌЫљвддкИУЗДгІжаЃЌO3жаOдзгВЛЪЧШЋВПзібѕЛЏМСЃЌВПЗжЛЏКЯМлВЛБфЃЛЖјNa2SO4 жаSгЩ+6МлЁњ+7МлЃЌЫљвдевГіЯргІЕФбѕЛЏМСЁЂЛЙдМСЁЂбѕЛЏВњЮяКЭЛЙдВњЮяКѓЃЌгУШБЯюХфЦНЪщаДЛЏбЇЗНГЬЪНЕУЃК2Na2SO4 + O3 + H2O = Na2S2O8 + 2NaOH + O2 ЁЃ
ЃЈ4ЃЉЂйЭМaжаУїЯдПЩвдПДГіЃЌЫцзХКсзјБъpHЕФдіДѓЃЌ4-CPНЕНтТЪж№НЅМѕаЁЃЌЖјЦ№ЕННЕНтзїгУЕФЪЧОпгаЧПбѕЛЏадЕФздгЩЛљЃЈSO4-ЁЄЃЉЃЌЫљвдНВНтТЪНЕЕЭЫЕУїЧПбѕЛЏздгЩЛљМѕЩйЃЌЫљвдЫсаддіЧПВХгаРћгкNa2S2O8ВњЩњSO4-ЁЄЁЃ
ЂкИљОнЭМbПЩвдПДГіЃЌПЊЪМЕФвЛЖЮЪБМфФкЫцзХКсзјБъFe2+ХЈЖШдіДѓЃЌ4-CPНЕНтТЪдкдіДѓЃЌЫљвдЫЕУїдкетЖЮЪБМфФкЃЌFe2+ФмЪЙNa2S2O8ВњЩњИќЖрЕФSO4-ЁЄЃЌAе§ШЗЁЃЧПбѕЛЏадздгЩЛљЪЧЭЈЙ§S2O82- + Fe2+= SO4-ЁЄ+ SO42- + Fe3+ЗДгІВњЩњЕФЃЌЫљвдFe2+ ВЛЪЧНВНтЗДгІЕФДпЛЏМСЃЌBДэЮѓЃЛвђЮЊздгЩЛљSO4-ЁЄгаЧПбѕЛЏадЃЌЫљвдШєFe2+ ХЈЖШЙ§ДѓЃЌдђРДВЛМАЗДгІЕФFe2+ ЛсБЛЩњГЩЕФздгЩЛљбѕЛЏЃЌЕМжТздгЩЛљМѕЩйЃЌНЕНтТЪЯТНЕЃЌCе§ШЗЃЌDДэЮѓЃЛЙЪбЁACЁЃ
ЂлЕБc(Fe2+)ЃН3.2 ЁС10-3 molЁЄLЃ1ЪБ,ДгЭМЯёbжаПЩвдевЕНДЫЪБЕФНЕНтТЪ52.4%ЃЌЖјГѕЪМХЈЖШЮЊc(4-CP)=1.56ЁС10-4 molЁЄLЃ1 ЃЌЫљвддк240minФкЕФЗДгІЫйТЪv=ЁїC/Ёїt=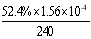
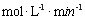 ЁЃ
ЁЃ
ПМЕуЃКБОЬтПМВщЕФЪЧИЧЫЙЖЈТЩгІгУЁЂЕчЛЏбЇжаЕчМЋЗДгІЪНЕФЪщаДЁЂбѕЛЏЛЙдЗДгІЗНГЬЪНЕФХфЦНЁЂЛЏбЇЗДгІЫйТЪЕФМЦЫуЕШЮЪЬтЁЃ


 еуДѓгХбЇаЁбЇФъМЖЯЮНгНнОЖеуНДѓбЇГіАцЩчЯЕСаД№АИ
еуДѓгХбЇаЁбЇФъМЖЯЮНгНнОЖеуНДѓбЇГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКдФЖСРэНт
| pH | 3.0 | 4.0 | 5.0 | 6.0 |
| t/min | ||||
| T/Ёц | ||||
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| 0.012ac |
| V |
| 0.012ac |
| V |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКдФЖСРэНт
| ЪБМф/minХЈЖШЃЈmol/LЃЉ | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0?30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
| ||
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
| pH t/min T/Ёц |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com