
| A. | 向氯化铝溶液中加入过量稀氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 向小苏打溶液中加入醋酸溶液:HCO3-+CH3COOH═CH3COO-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入二氧化碳CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
分析 A.氨水为弱碱,二者反应生成氢氧化铝沉淀;
B.小苏打为碳酸氢钠,二者反应生成醋酸钠、二氧化碳气体和水;
C.苯酚的酸性大于碳酸氢钠,二者反应生成碳酸氢钠;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.氯化铝与氨水反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.向小苏打溶液中加入醋酸溶液,反应的离子方程式为:HCO3-+CH3COOH═CH3COO-+CO2↑+H2O,故B正确;
C.苯酚钠溶液中通入二氧化碳,反应生成苯酚和碳酸氢钠,正确的离子方程式为:CO2+H2O+C6H5O-→C6H5OH+HCO3-,故C错误;
D.溴化亚铁溶液中通入过量氯气,二者发生氧化还原反应,正确的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++Br2+6Cl-,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫 氯气 | B. | 二氧化氮 二氧化硫 | ||
| C. | 氨气 二氧化碳 | D. | 氯气 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥
→合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -483.6kJ•mol-1 | B. | -241.8kJ•mol-1 | C. | -120.6kJ•mol-1 | D. | +241.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
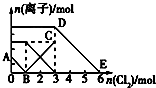 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法不正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法不正确的是( )| A. | 线段BC代表Fe3+物质的量的变化情况 | |
| B. | 原混合溶液中n(FeBr2)=3mol | |
| C. | 当通入2molCl2时,溶液中已发生的离子反应为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )| A. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| B. | 甲苯$\stackrel{氧化甲基}{→}$X$\stackrel{硝化}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| C. | 甲苯$\stackrel{还原}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{硝化}{→}$对氨基苯甲酸 | |
| D. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{还原硝基}{→}$Y$\stackrel{氧化甲基}{→}$对氨基苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中有水参加反应 | |
| B. | 反应后溶液呈无色 | |
| C. | 该反应的还原剂为K2S2O8 | |
| D. | MnSO4和K2S2O8的化学计量数分别为、2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com