
| A. | 充入氮气 | B. | 减小压强,扩大容器体积 | ||
| C. | 加入催化剂 | D. | 适当升高温度 |
分析 该反应是一个反应前后气体计量数减小的可逆反应,升高温度、增大浓度、增大压强、加入催化剂都能改变反应速率,据此分析解答.
解答 解:A.增大反应物氮气的浓度,单位体积内活化分子的数目增多,反应速率加快,故A不选;
B.减小压强,扩大容器体积,单位体积内活化分子个数减小,会导致化学反应速率减慢,故B选;
C.加入催化剂,能增大活化分子百分数,所以反应速率加快,故C不选;
D.升高温度,活化分子的百分数增大,使正、逆化学反应速率加快,故D不选;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、温度、压强、催化剂对反应速率影响原理是解本题关键,注意各个因素适用范围,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(OH):③>①>② | |
| B. | 溶液的pH:②>③>① | |
| C. | ①和②等体积混合后的溶液:c(Na+)═c(H2C03)+c(HC03)+c(C032-) | |
| D. | ①和③等体积混合后的溶液:c(Na+)>c(HC03-)>c(C032-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
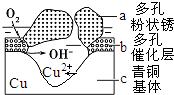 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
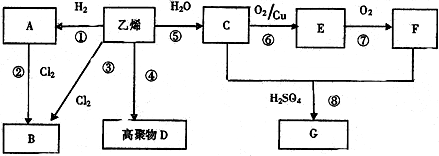
 ,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.
,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| HNO3(HCl) | ||
| ZnSO4(CuSO4) | ||
| NaCl(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| B. | 向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
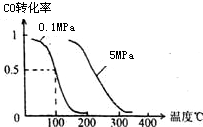 (1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com