
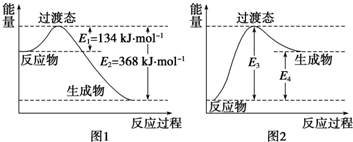
分析 (1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
图中E1是活化能,即该反应的活化能为134kJ•mol-1;
(2)E3即为逆反应的活化能,E4是反应物与生成物的能量之差,即为反应热.
解答 解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)═NO(g)+CO2(g)
△H=-234kJ•mol-1,图中E1是活化能,即该反应的活化能为134kJ•mol-1;
故答案为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJ•mol-1;134;
(2)E3即为逆反应的活化能,即为368KJ/mol,E4是该反应的反应热,即为234KJ/mol,故答案为:368;234.
点评 本题考查了热化学方程式的书写,为高频考点,侧重于学生的分析、计算能力的考查,注意把握图象的意义、正逆反应的反应热数值相等、符号相反,难度不大.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | SO3 | C. | C12 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、OH- | B. | Na+、Cl-、OH-、AlO2- | ||
| C. | Na+、Cl-、Al3+ | D. | Na+、Cl-、AlO2-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物分子必须碰撞才有可能发生反应 | |
| B. | 反应速率大小与单位时间内反应物分子间的碰撞次数成正比 | |
| C. | 有效碰撞是活化分子在一定方向上的碰撞 | |
| D. | 活化分子的平均能量称为活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 原子半径:B>A>C>D | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ⑤③④①② | C. | ③④⑤②① | D. | ⑤②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com