
分析 混合气体的体积为8.96L,则物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,根据气体的总质量和总物质的量列方程式计算.
解答 解:混合气体的体积为8.96L,则物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,混合气体的平均摩尔质量为:$\frac{14.4g}{0.4mol}$=36g/mol,
设混合气体中CO的物质的量为xmol,CO2的物质的量为ymol,则28x+44y=12.8,x+y=0.4,
解得x=0.3mol,y=0.1mol
所以m(CO)=0.3mol×28g/mol=8.4g,m(CO2)=4.4g,
标况下一氧化碳和二氧化碳体积为22.4L/mol×0.3mol=6.72L,22.4L/mol×0.1mol=2.24L,混合气体中碳、氧原子的质量比是(0.3+0.1)×12:(0.3+0.1×2)×16=3:5,
答:(1)混合气体的平均相对分子质量为36;
(2)两种气体混合前的质量m(CO)=8.4g,m(CO2)=4.4g,体积各是6.72L、2.24L;
(3)混合气体中碳、氧原子的质量比是3:5.
点评 本题考查混合物的计算,题目难度不大,注意有关计算公式的运用,注意平均相对分子量的求法.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,C12 可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙二酸可与高锰酸钾溶液发生反应 | |
| C. | 乙醇和乙烯的混合物 lmol,完全燃烧消耗 3molO2 | |
| D. | 光照下 2,2-二甲基丁烷与 Br2 反应,其一溴取代物只有 2 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X | B. | Xg | C. | $\frac{X}{{N}_{A}}$g | D. | $\frac{1}{{N}_{A}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加FeCl3饱和溶液可以制备Fe(OH)3胶体 | |
| B. | 用纯碱溶液清洗油污时,加热可以增强其去污能力 | |
| C. | 向纯水中加入稀硫酸或降温都能使水的离子积减小 | |
| D. | 锅炉中沉积的CaSO4可用足量Na2CO3溶液浸泡后,再用稀盐酸溶解掉不溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验顺序 | 加热前/g | 加热后/g |
| 1 | 3.44 | 3.26 |
| 2 | 3.44 | 3.12 |
| 3 | 3.44 | 2.90 |
| 4 | 3.44 | 2.90 |
| 5 | 3.44 | 2.80 |
| 6 | 3.44 | 2.78 |
| 7 | 3.44 | 2.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | CO2的原子晶体和CO2的分子晶体具有相同的物理性质 | |
| C. | 对于CO2原子晶体,“CO2”是化学式,不是分子式 | |
| D. | CO2原子晶体在一定条件下转化为分子晶体的变化是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
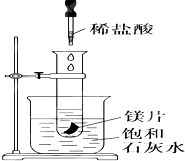 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com