
分析 (1)压强越大反应速率越快,而反应①:CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g)正向气体计量数减小,
反应②:CH3COOCH3(g)+C2H5OH(g)?CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,反应③:C2H5OH(g)?CH3CHO(g)+H2(g)正向气体计量数增加;
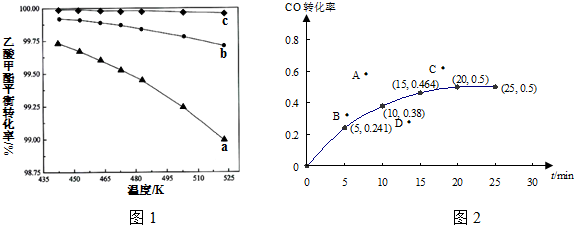
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应;乙酸甲酯的转化率越小,则氢碳比($\frac{n({H}_{2})}{n(乙酸甲酯)}$)越大;
(2)①CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;压强之比等于物质的量之比;
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小;
(3)根据盖斯定律解题;设燃料为1kg计算.
解答 解:(1)压强越大反应速率越快,而反应①:CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g)正向气体计量数减小,所以平衡正向移动,
反应②:CH3COOCH3(g)+C2H5OH(g)?CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,增大压强平衡不移动,反应③:C2H5OH(g)?CH3CHO(g)+H2(g)正向气体计量数增加,增大压强平衡逆向移动,故答案为:增大压强,也能提高反应速率.反应①为气体分子数减小的反应,反应②气体分子数不变,反应③为气体分子数变大的反应,增大压强反应①平衡正向移动,反应②平衡不移动,反应③平衡逆向移动,总结果,乙醇含量增大;
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应,所以温度升高K值减小;乙酸甲酯的转化率越小,则氢碳比($\frac{n({H}_{2})}{n(乙酸甲酯)}$)越大,所以最大的是c,故答案为:变小; c;
(2)①CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.25}{0.25×0.{5}^{2}}$=4.0,$\frac{12.6}{3}=\frac{P}{3-0.38×2}$,所以P=9.4 MPa,故答案为:4.0;9.4 MPa;
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小,所以点B符合,故答案为:B;
(3)①CH4(g)+H2O(1)?CO(g)+3H2 (g)△H=+250.1kJ.mol-l
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
①+②+③×3得
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
设燃料为1kg,放出的能量为$\frac{1000}{16}$×890.3KJ×86.4%=4.8×107J;比能量为$\frac{4.8×1{0}^{7}J}{3.6×1{0}^{6}J}$,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;$\frac{4.8×1{0}^{7}J}{3.6×1{0}^{6}J}$.
点评 本题综合考查化学平衡的影响因素、CH4燃烧热的热化学方程式书写、比能量的应用,主要考查盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “胃得乐”(主要成分为碳酸镁)是一种抗酸药) | |
| B. | 鸦片、吗啡、海洛因等这些物质属于毒品 | |
| C. | 青霉素能抑制细菌细胞壁的生长,致使细菌因细胞破裂而死亡 | |
| D. | “阿司匹林”是一种重要的抗生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a% | B. | 1-1.75% | C. | 4(l-a%)7 | D. | 3(l-a%)7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 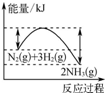 如图反应达到平衡后,升高温度,平衡向生成氨气的方向移动 | |
| B. |  如图表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响 | |
| C. | 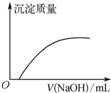 如图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 | |
| D. | 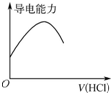 如图表示向氨水中通入HCl气体,溶液的导电能力变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
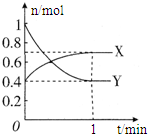 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 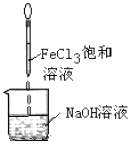 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com