
【题目】将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示. 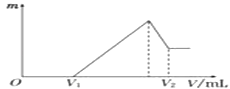
当V1=160mL时,则金属粉末中n(Mg)=mol,n(Al)=mol,V2=mL.
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL.
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL 2mol/L的硫酸溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3 . 满足此条件的a的取值范围是 .
【答案】
(1)0.06;0.04;440
(2)400
(3)0.5≤a<1
【解析】解:(1)当V1=160mL时,此时溶液是MgSO4、Al2(SO4)3和Na2SO4混合液, 由Na+离子守恒可知,n(Na2SO4)= ![]() n(Na+)=
n(Na+)= ![]() n(NaOH)=
n(NaOH)= ![]() ×0.16L×1mol/L=0.08mol,
×0.16L×1mol/L=0.08mol,
设MgSO4为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1,
100mL 2mol/L的H2SO4溶液中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,
根据SO42﹣离子守恒有:x+3y=0.2﹣0.08=0.12,
联立方程解得:x=0.06、y=0.02,
所以金属粉末中:n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol;
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42﹣离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.2mol+0.04mol=0.44mol,
则V2点消耗氢氧化钠溶液的体积为: ![]() =0.44L=440mL,
=0.44L=440mL,
所以答案是:0.06;0.04;440;(2)使Mg2+、Al3+刚好完全沉淀,此时溶质为硫酸钠,则n(NaOH)=2n(Na2SO4)=0.4mol,加入的NaOH的体积V为:V= ![]() =400mL,
=400mL,
所以答案是:400mL;(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2molL﹣1硫酸溶解后,再加入450mL 1molL﹣1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知镁离子、铝离子恰好完全沉淀时消耗400mL氢氧化钠溶液,再加入50mL 1molL﹣1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,
所以答案是:0.5≤a<1.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关糖类的叙述,错误的是
A. 核酸的组成成分中有单糖 B. 葡萄糖是细胞内主要的能源物质
C. 淀粉和糖原是人体内的储能物质 D. 纤维素是植物细胞壁的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得: 。下列有关说法不正确的是( )
。下列有关说法不正确的是( )
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应
D. 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列观点错误的是( )
A.硝酸铵、液氨可用作制冷剂
B.苏打、小苏打可用作食用面碱
C.二氧化氯、漂白粉可用作自来水的杀菌消毒剂
D.氧化铝、二氧化硅可用作制坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代科技将20984Po涂于飞机表面,可以吸收和屏蔽雷达波和红外线辐射,从而达到隐形目的。下面列出该原子核内中子数与核外电子数之差的数据正确的是( )
A. 41 B. 84 C. 125 D. 209
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出). 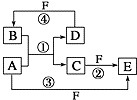
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,B为无色气体,则A在周期表中的位 置为第周期族,反应④的化学方程式 .
(2)若A是常见的变价金属的单质,D、F均为气态单质,且F为黄绿色,光照条件下D与F会发生反应.已知反应①和②均在水溶液中进行,则检验C中阳离子的操作步骤是: .
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,D是制取集成电路的主要原料,则B在通讯领域用来作 , 反应①的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述正确的是( )
A.新制氯水可使蓝以石蕊试纸先变红,后褪色
B.新制氯水中只含有Cl2和H2O分子
C.氯水放置数天后,酸性增强
D.光照氯水有气泡逸出,该气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等离子体的用途十分广泛,运用等离子束切割金属或者代替手术刀进行外科手术,利用的等离子体的特点是( )
A.微粒带有电荷B.具有很高的温度C.基本构成微粒多样化D.准电中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com