
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
分析 的M电子层有1个电子,应为Na元素,b的最外层电子数为内层电子数的2倍,应为C元素,c的最高化合价为最低化合价绝对值的3倍,应为S元素,c与d同周期,d的原子半径小于c.应为Cl元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:a的M电子层有1个电子,应为Na元素,b的最外层电子数为内层电子数的2倍,应为C元素,c的最高化合价为最低化合价绝对值的3倍,应为S元素,c与d同周期,d的原子半径小于c.应为Cl元素,
A.同周期元素从左到右元素的非金属性逐渐增强,元素非金属性强弱顺序为Cl>S>C>Na,故A正确;
B.四种元素形成的氧化物有CO、CO2;Na2O、Na2O2;SO2、SO3,而Cl的化合价有多种,则氧化物也有多种,如ClO2、Cl2O等,故B正确;
C.a为Na,为金属,可与其他元素生成离子化合物,含有离子键,故C正确;
D.非金属性S<Cl,元素的非金属性越强,对应的氢化物的还原性越弱,故D错误.
故选D.
点评 本题为2015年考题改编题,涉及原子结构与元素周期率的考查,侧重于学生的分析能力的培养和原子结构、元素周期率的综合应用的考查,注意把握提给信息以及元素周期率的递变规律,难度不大.


科目:高中化学 来源: 题型:选择题
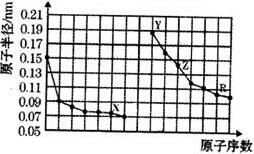
| A. | X、Y两种单质在常温下反应生成的产物为碱性氧化物 | |
| B. | Z2R3可由Y2R和ZCl3的溶液反应制取 | |
| C. | Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

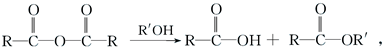

 .
. .
.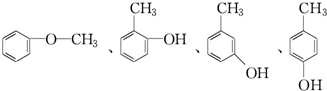 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +4 | C. | 0 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,是因为△H<0 | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r({F}^{-})}{r({O}^{2-})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(Ca)}{r(Mg)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 往燃煤中混入生石灰,可减少SO2排放 | |
| D. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
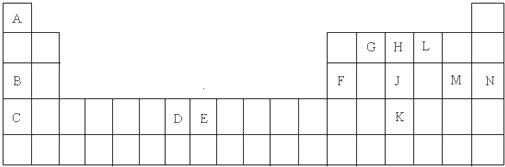
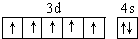 ,在其化合物中,最高正价是+7;
,在其化合物中,最高正价是+7;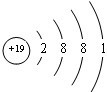 ;
;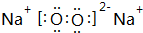 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com