
| 元素 | 相关信息 |
| W | 最高价氧化物既能与强碱又能与强酸反应形成盐和水,又可作耐火材料 |
| X | 以化合态广泛存在于自然界,单质可用于制造集成电路 |
| Y | 基态原子核外有4个未成对电子 |
| Z | 其硫酸盐常用于检验或除去乙醇、乙醚等有机溶剂中的少量水分 |
| ||
| ||


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| W | W的基态原子核外3个能级上有电子,且每个能级上的电子数相等. |
| X | X原子核外L层电子数为奇数 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z在同周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
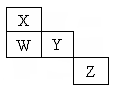 如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )
如图为元素周期表前四周期的一部分,W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如表中所示.下列有关叙述中正确的是( )| A、Z元素一定是金属元素 | B、X、Y、W一定是主族元素 | C、W的氢化物的沸点一定比X的氢化物的沸点高 | D、Z既可能在三周期,也可能在四周期 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省黄山市毕业班第一次质量检测化学试卷(解析版) 题型:填空题
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
元素 | 相关信息 |
W | W的基态原子L层电子数是K层电子数的3倍 |
X | X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
Y | 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
Z | Z的基态原子外围电子排布式为(n-1)d10ns1 |
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是??????????? 。
(2)W的简单离子半径???? X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的???? (填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是??????? (填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为??????? 。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
???????????????????????? (任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是?????? ? ???? ???????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2013届河北省五校联盟高三上学期调研考试理科综合化学试卷(解析版) 题型:选择题
W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如图所示。
下列有关叙述中正确的是

A.Z元素一定是金属元素
B.X、Y、W一定是主族元素
C.若W的单质在空气中燃烧有三种固体产物,则Y的单质既能与强酸溶液反应又能与强碱溶液反应
D.Z既可能在三周期,也可能在四周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com