
(16分)在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
⑴c3(D) / c3(B) ;< ;⑵ 0.06 mol·L-1·min-1;80% ;20% ⑶ CD ;⑷ >0.08 ;⑸ BD 。
解析试题分析:根据化学平衡常数的定义可得K= c3(D) / c3(B)。由于升高温度,平衡常数减小。说明升高温度,化学平衡向逆反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。因此ΔH<0. ⑵1000 ℃时,4 min后达到平衡.假设达到平衡时生成D的物质的量浓度为x,则消耗B的物质的量浓度也是x.平衡时B的浓度为(0.3-x)mol/L.x3/(0.3-x)3=64.0。解得x=0.24mol/L.则4 min内D的平均反应速率v(D)=0.24mol/L÷4min=0.06mol/(L·min)。B的转化率为(0.24mol/L÷0.3mol/L)×100%=80%. 因为在反应达到平衡时B的物质的量浓度为(0.3-x)mol/L=(0.3-0.24)mol/L=0.06mol/L该反应是个反应前后气体体积相等的反应,元素平衡时B的体积分数(0.06mol/L÷0.3mol/L)×100%=20%. ⑶A.由于C是固体,所以减少C的量,对化学平衡的移动无影响。错误。B.由于A的状态是固体,所以增加A的量,平衡不移动,错误。C.移出部分D,加成生成物的浓度,平衡正向移动,B的平衡转化率提高。正确。D.降低反应温度,平衡正向移动,B的平衡转化率提高。正确。E.减小容器的容积,因为该反应是反应前后气体体积相等的反应,所以改变压强,化学平衡不移动。错误。F.加入合适的催化剂,正反应、逆反应的速率加快,但是平衡不发生移动。错误。因此正确选项为CD。(4)在反应开始时c(D)=0.3mol/L.当反应达到平衡后,c(B)= 0.06mol/L,因为在方程式中B、D的系数相同,因此D的平衡浓度为c(D)(平衡)=0.24mol/L.由于在化学方程式A(s)+3B(g)  2C(s)+3D(g)中C:B=2:3,所以消耗的C的物质的量为0.06mol/L×2L×2/3=0.08mol。该反应为可逆反应,当达到平衡后还应该存在C物质。因此开始时加入的C的物质的量应该比0.08mol多。即X>0.08mol。⑸A.由于该反应是反应前后气体体积相等的可逆反应,无论反应是否达到平衡,容器内混合气体的压强都不随时间变化而变。错误。B.因为B是气态物质。若它的速率不随时间的变化而变化,说明其浓度不再发生变化,反应达到平衡。正确。C.由于在方程式中二者的系数相同,所以任何时刻c(B)︰c(D)=1︰1。不能说明反应达到平衡状态。错误。D.因为参加反应的物质有固体,而且M(B)≠M(D)。若反应达到平衡状态,各种气体的质量不变,总质量不变,混合气体的密度保持不变;若反应未达到平衡,则混合气体的质量就要发生变化,则混合气体的密度就要发生变化,因此该项内容能作为反应达到平衡的标志。正确。
2C(s)+3D(g)中C:B=2:3,所以消耗的C的物质的量为0.06mol/L×2L×2/3=0.08mol。该反应为可逆反应,当达到平衡后还应该存在C物质。因此开始时加入的C的物质的量应该比0.08mol多。即X>0.08mol。⑸A.由于该反应是反应前后气体体积相等的可逆反应,无论反应是否达到平衡,容器内混合气体的压强都不随时间变化而变。错误。B.因为B是气态物质。若它的速率不随时间的变化而变化,说明其浓度不再发生变化,反应达到平衡。正确。C.由于在方程式中二者的系数相同,所以任何时刻c(B)︰c(D)=1︰1。不能说明反应达到平衡状态。错误。D.因为参加反应的物质有固体,而且M(B)≠M(D)。若反应达到平衡状态,各种气体的质量不变,总质量不变,混合气体的密度保持不变;若反应未达到平衡,则混合气体的质量就要发生变化,则混合气体的密度就要发生变化,因此该项内容能作为反应达到平衡的标志。正确。
考点:考查平衡常数表达式、反应热的判断、化学反应速率的计算、平衡时物质的转化率及含量的计算、提高反应物转化率的措施、化学平衡状态的判断的知识。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:填空题
(5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
| 时间(h) 物质的量(mol) | | 0 | 1 | 2 | 3 | 4 |
| N2 | | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
.(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g) △H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l) △H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l) △H4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)= 。列式计算上述反应的平衡常数K = 。
(2)有关反应:(t-BuNO)2 2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。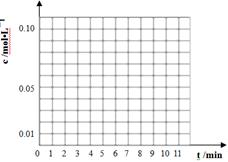
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①4NH3(g)+3O2(g)===2N2(g)+6H2O(g)  H=-1266.8kJ·mol-1
H=-1266.8kJ·mol-1
②N2(g)+O2(g)===2NO(g) 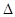 H=180.5kJ·mol-1
H=180.5kJ·mol-1
写出氨高温催化氧化的热化学方程式 。
(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2===2N2+6H2O。则原电解质溶液显 (填“酸性”、“中性”或“碱性”),负极的电极反应式为 。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: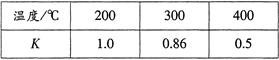
①由上表数据可知该反应为放热反应,理由是 ;
②理论上,为了增大平衡时H2的转化率,可采取的措施是 (填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2mol·L-1、1mol·L-1时,此时刻该反应的v正(N2) v逆(N2)(填“>”、“<”或“=”)。
(4)①25oC时,将amol·L-1的氨水与0.1mol·L-1的盐酸等体积混合。当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= ;
②向25mL0.10mol·L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是 (填字母序号)。
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
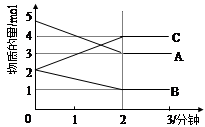
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为 (填“酸性”或“碱性”)溶液,其原因用离子方程式解释是: 。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有
A.CaCl2溶液 B.氨水 C.Ca(OH)2悬浊液 D.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g) + 2CO(g)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
①该反应平衡常数表达式K= ;温度升高K值 (填“增大”或“减小” )
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。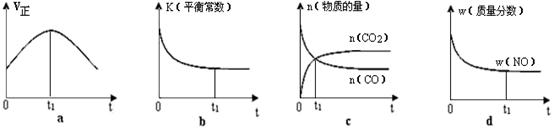
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为: Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池的正极应与外接电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32- 2I-+ S4O62-(快)
2I-+ S4O62-(快)
向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |

 2LiI(s)ΔH
2LiI(s)ΔH 2Li2O(s) ΔH1 ②4LiI(s)+O2(g)
2Li2O(s) ΔH1 ②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: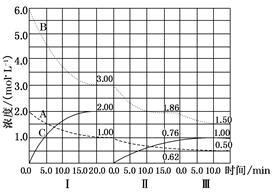
回答问题:
(1)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 ,其值是 ;
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(3)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”、“<”、“=”),判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g) SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com