
| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法确定 |
科目:高中化学 来源: 题型:填空题
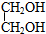 ,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
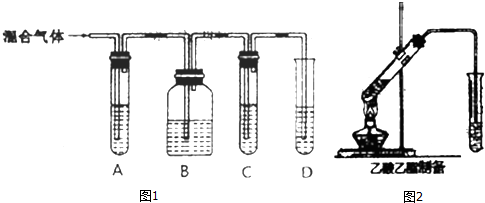
 CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).
CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中不可能含有离子键 | |
| B. | 只有金属元素和非金属元素才能形成离子键 | |
| C. | 水分子很稳定,因为水分子间存在氢键 | |
| D. | 所有的分子晶体内都存在两种以上作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象相同,沉淀量不等 | ||
| C. | 现象不同,沉淀量相等 | D. | 现象不同,沉淀量不等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
反应C(s)+H2O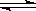 CO(g)+H2(
CO(g)+H2( g)△H>0,达到平衡时,下列说法正确的是( )
g)△H>0,达到平衡时,下列说法正确的是( )
A.加入催化剂,平衡常数不变 B.减小容器体积,正、逆反应速率均减小
C.增大C的量,H2O的转化率增大 D.升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com