
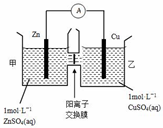
| A. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 铜电极上发生氧化反应 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
分析 由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,以此解答该题.
解答 解:A.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故A正确;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B错误;
C.锌为负极,铜为正极,正极上铜离子得电子发生还原反应,故C错误;
D.阳离子交换膜只允许阳离子通过,阴离子不能通过阳离子交换膜,故D错误.
故选A.
点评 本题考查原电池工作原理,侧重于学生的分析能力的考查,注意把握原电池的工作原理,题目比较基础,注意阳离子交换膜不允许阳离子通过,D选项利用电荷守恒分析.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
 实验室要配制2mol/L稀硫酸250mL.
实验室要配制2mol/L稀硫酸250mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (K+)>c (CH3COO-)>c(H+)>c (OH-) | B. | c(K+)=c (CH3COO-)>c (OH-)=c (H+) | ||
| C. | c(K+)+c (H+)═c(CH3COOH)+c (OH-) | D. | c (CH3COOH)+c (CH3COO-)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol•L-1 | 0.05mol•L-1 | 3.5 |
| 2 | 0.1mol•L-1 | 0.1mol•L-1 | x |
| 3 | 0.2mol•L-1 | 0.2mol•L-1 | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
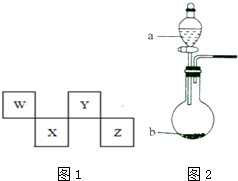 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.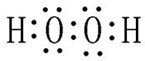 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜与烧碱溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠溶液中加入足量盐酸:Na2CO3+2H+═Na++CO2↑+H2O | |
| D. | 氢氧化铝中和胃酸(盐酸):Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com