
【题目】按要求完成下列小题.
(1)0.5mol NH3共含有个电子
(2)27.75g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl﹣ , 则M的相对原子量为
(3)如图是某化学实验室从化学试剂商店买回的盐酸试剂标签上的部分内容 ①该浓盐酸的物质的量浓度
②用该浓盐酸配制200mL1mol/L的稀盐酸所需该浓盐酸的体积是mL(用量筒量取)
【答案】
(1)5NA
(2)40
(3)11.9mol/L;16.8
【解析】解:(1)0.5molNH3中含有0.5mol氮原子,1.5mol的氢原子,含有质子物质的量=0.5mol×10=5mol,电子的个数为:0.5×10×NA=5NA , 故答案为:5NA;(2)27.75g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl﹣ , 3.01×1023个Cl﹣的物质的量为:n(Cl﹣)= ![]() mol=0.5mol,MCl2的物质的量为:n(MCl2)=
mol=0.5mol,MCl2的物质的量为:n(MCl2)= ![]() ×0.5mol=0.25mol,M(MCl2)=
×0.5mol=0.25mol,M(MCl2)= ![]() =111g/mol,则M的相对原子质量为:111﹣36.5×2=40,故答案为:40;(3)①根据c=
=111g/mol,则M的相对原子质量为:111﹣36.5×2=40,故答案为:40;(3)①根据c= ![]() 可知,该盐酸的物质的量浓度为
可知,该盐酸的物质的量浓度为 ![]() mol/L=11.9mol/L;②根据稀释定律,稀释前后溶质的物质的量不变,需要浓盐酸的体积为
mol/L=11.9mol/L;②根据稀释定律,稀释前后溶质的物质的量不变,需要浓盐酸的体积为 ![]() =16.8mL, 故答案为:11.9mol/L;16.8.
=16.8mL, 故答案为:11.9mol/L;16.8.
(1)1mol氨气分子中含有1molN原子、3molH原子,每个NH3分子含有10个质子,故质子物质的量为NH3分子的10倍,根据分子呈电中性,电子的物质的也是分子物质的量的10倍,由此分析解答;(2)根据n= ![]() 计算出3.01×1023个Cl﹣的物质的量,再根据化学式MCl2计算出MCl2的物质的量,再根据M=
计算出3.01×1023个Cl﹣的物质的量,再根据化学式MCl2计算出MCl2的物质的量,再根据M= ![]() 计算出M的摩尔质量,摩尔质量在数值上等于其相对原子或分子质量;(3)①根据c=
计算出M的摩尔质量,摩尔质量在数值上等于其相对原子或分子质量;(3)①根据c= ![]() 计算该盐酸的物质的量浓度;②根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓盐酸的体积.
计算该盐酸的物质的量浓度;②根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓盐酸的体积.


科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①试管 ②蒸发皿 ③烧杯 ④烧瓶 ⑤坩埚 ⑥容量瓶 ⑦量筒 能用酒精灯直接加热的是
A. ①②③④⑤ B. ①②③④⑥ C. ①②⑤ D. ②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的分子式为C3H6O2,它在酸性条件下能水解,水解产物只有两种,且这两种产物的相对分子质量相等,该有机物X的结构简式是( )
A.CH3CH2COOHB.CH3COOCH3
C.HCOOCH2CH3D.HOCH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应的是( )
A. CO32-+H2O![]() HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. Al3++3A1O2-+6H2O=4Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组专门研究了氧族元素及其某些化合物的部分性质。所查资料信息如下:
①酸性:H2SO4>H2SeO4>H2TeO4
②氧、硫、硒与氢气化合越来越难,碲与氢气不能直接化合
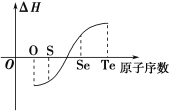
③由元素的单质生成等物质的量的氢化物的焓变情况如上图所示:
请完成下列问题:
(1)H2与硫化合的反应______热量(填“放出”或“吸收”)。
(2)已知H2Te分解反应的ΔS>0,请解释为什么Te和H2不能直接化合_________________________________________。
(3)上述资料信息中能够说明硫元素非金属性强于硒元素的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下KMnO4氧化浓HCl的反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目
(2)又已知MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
(3)浓盐酸在反应中显示出来的性质是 (填编号)
A只有还原性 B还原性和酸性 C只有氧化性 D氧化性和酸性
(4)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l)
5N2(g) + 6H2O(l) ![]()
反应②:2NO(g) + O2(g) ![]() 2NO2(g)
2NO2(g) ![]() (
( ![]() < 0且
< 0且![]() =2
=2![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l)
5N2(g)+ 3O2 + 6H2O(l) ![]()
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
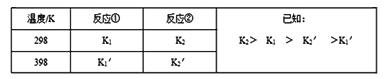
(1)试推测反应③是______ 反应(填“吸热”或“放热”)。
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。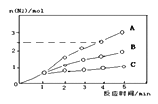
则:①计算0~4min时在A催化剂作用下,反应速率v(NO)=_______________
②下列说法正确的是:________________________
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO 和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_________(填“是”或“不是”已知该温度下该反应的K约为147.3).达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com