
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 12种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 验证氯气能否与水反应的实验时,用氢氧化钠溶液处理尾气 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态碳原子核外电子排布图是: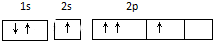 | |
| B. |  和 和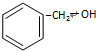 是同系物,性质相似 是同系物,性质相似 | |
| C. | 过氧化钠的电子式: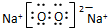 | |
| D. | 常见的化学键有:离子键、共价键、金属键、氢键等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
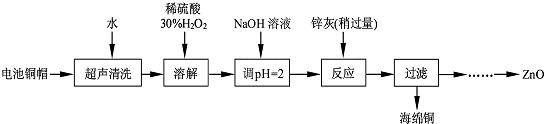
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 向Fe(NO3)3溶液中通入足量HI气体:2Fe3++2I-═2Fe2++I2 | |
| C. | 向NaHCO3溶液中滴入少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向水玻璃溶液中通入过量CO2:SiO32-+H2O+CO2═CO32-+H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 甘油(水):用分液漏斗分离 | |
| C. | 苯(苯酚):加NaOH溶液,充分振荡,分液 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L SO3 中含有2NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com